2025-04-17
有临来雅

最新进展:美国FDA就Dataset-JSON格式征求意见
2025年4月9日FDA就未来是否接受将Dataset-JSON作为监管申请中电子研究数据交换标准一事征求公众意见,意见反馈截止日期为2025年6月9日[1]。征求意见稿提及FDA正在探索采用临床数据交换标准协会(CDISC)的Dataset-JSON v1.1作为新的交换标准,未来替代SAS XPORT v5用于向生物制品评价与研究中心(CBER)和药品评价与研究中心(CDER)提交电子研究数据。该征求意见稿建议公众从以下两方面反馈意见:
在此之前,2023年7月至2024年6月,制药行业用户软件交流协会(PHUSE:Pharmaceutical Users Software Exchange)、临床数据交换标准协会(CDISC)与美国食品药品监督管理局(FDA)三方携手,开展了一项具有里程碑意义的“Dataset-JSON作为监管递交替代传输格式”试点项目。这项历时近一年的研究所发布的最终报告揭示了一个重要行业趋势:JSON格式正逐步获得FDA的官方认可,有望成为未来临床试验数据递交的新标准[2]。
根据FDA最新版《以电子格式提供监管提交—标准化研究数据行业指南》(2021年6月Revision 2)[3],目前FDA仍主要接受SAS XPT(V5传输格式)作为标准递交格式。但值得关注的是,FDA的“数据现代化行动计划”(Data Modernization Action Plan)已明确将鼓励使用更现代的数据格式作为战略重点。此次试点正是这一战略的重要实践环节,标志着FDA向数据标准现代化迈出了实质性一步[4]。
试点项目吸引了来自全球顶尖制药公司、CRO和技术供应商的广泛参与,包括强生、默克、罗氏等19家机构提交了详细的测试反馈。FDA/CDER(药物评价与研究中心)也亲自参与了五个临床研究和三个非临床研究的测试递交,对Dataset-JSON的实际表现进行了全面评估。
01.JSON格式与CDISCDataset-JSON v1.1深度解析
JSON技术优势
JSON(JavaScript Object Notation)作为一种轻量级的数据交换格式,在现代信息技术领域已获得广泛应用,其核心优势包括:
CDISC Dataset-JSON v1.1创新特性
CDISC Dataset-JSON是专为满足监管递交需求而设计的现代化数据集格式,v1.1版本在以下方面实现了重要突破:
性能优化:
- 文件体积比传统XPT格式平均减小30-50%
- 新增NDJSON(Newline Delimited JSON)支持,可实现大数据集的流式处理
数据类型增强:
- 引入decimal数据类型,解决浮点数精度问题
- 采用ISO 8601标准表示日期时间,避免SAS与R等系统间的日期纪元差异
- 新增Boolean等ODM数据类型支持
结构简化:
- 扁平化数据结构,将"itemData"改为更直观的"rows"
- 用"columns"替代原有的"items"命名,提高可读性
元数据整合:
- 内置丰富元数据,减少对外部define.xml的依赖
- 新增targetDataType属性,明确数据类型转换规则
国际化支持:
- 默认采用UTF-8编码,完整支持非ASCII字符
- 解决了传统XPT格式在非英语字符处理上的局限性
02.Dataset-JSON与XPT格式全方位对比
技术规格对比
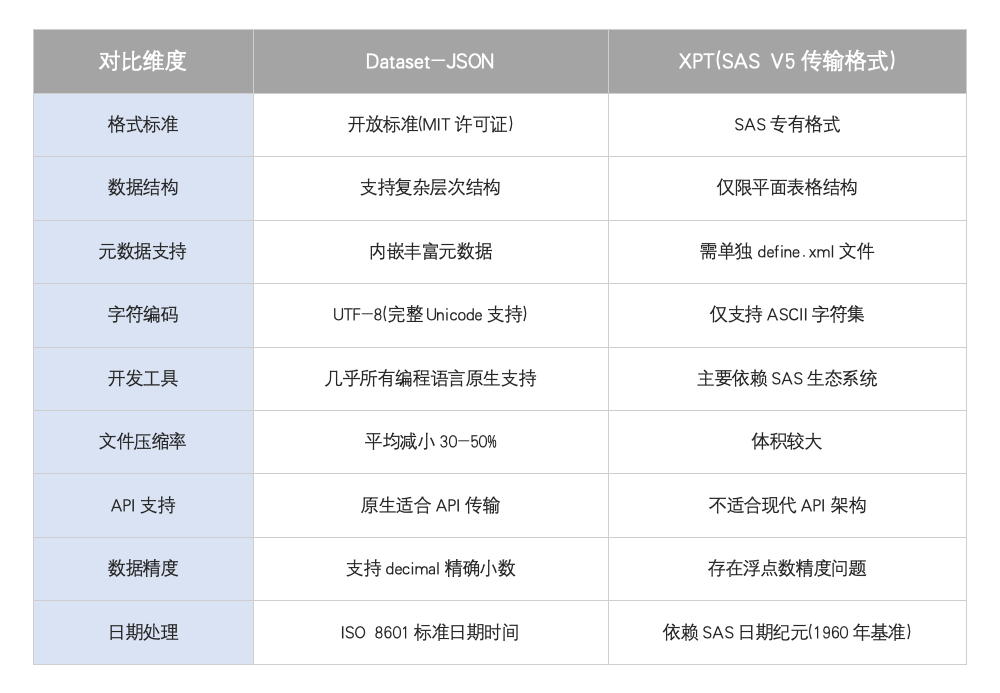
试点中发现的关键差异
数据处理能力:
- Dataset-JSON成功处理了包含非ASCII字符的测试案例,而XPT转换此类字符会存在一定问题
- 在包含长变量名(超过8个字符)的数据集中,Dataset-JSON表现完美,XPT则出现截断
工具兼容性:
- Dataset-JSON能被所有测试的数据管理工具正确解析
- 但当前主流分析工具(SAS、JMP等)尚未完全适配,需要代码调整
元数据完整性:
- Dataset-JSON转换回XPT时会丢失部分元数据
- 试点建议保留两种格式副本以确保数据追溯性
行业接受度:
- 89%的测试机构使用SAS进行格式转换
- 但95%的机构成功完成了双向转换,证明技术可行性
03.Dataset-JSON未来展望
短期(1-2年):
- XPT仍是主要递交格式
- Dataset-JSON在复杂数据结构、ePRO数据等场景试点应用
- 工具厂商(如SAS/JMP)更新软件支持,适配Dataset-JSON的元数据加载
- PHUSE/CDISC将继续制定商业案例和长期发展路线图
中期(2-3年):
- FDA可能发布Dataset-JSON采纳时间表
- 预计2025-2026年进入FDA数据标准目录
- 成为某些递交场景的推荐格式
长期(3-5年):
- 可能成为与XPT并列的标准格式
- 在API数据交换领域占据主导地位
- 全面释放CDISC标准的潜力
04.必备资源指南
核心规范文档:
CDISC Dataset-JSON Specification
监管政策文件:
FDA Study Data Technical Conformance Guide - March 2025
试点研究成果:
实用工具资源:
随着生命科学行业数字化转型加速,Dataset-JSON代表的数据现代化趋势已不可逆转。建议行业同仁把握这一变革机遇,从今天开始布局准备,共同迎接临床试验数据递交的新纪元。
Tips:定期查看FDA数据标准目录,及时获取Dataset-JSON采纳进展的最新信息!
Tips:可报名参加CDISC中国近期相关直播活动,详见CDISC中国公众号。
参考文献:
[1] FDA Requests Public Comment on CDISC Dataset-JSON Standard
[2] Dataset-JSON as an Alternative Transport Format for Regulatory Submissions: Final Pilot Report
[4] FDA Data Modernization Action Plan
撰写:李斯友、何志豪
审核:章飞燕、张子豹
有临来雅
上海有临医药子公司,成立于 2019 年,致力于给国内外创新药、疫苗与医疗器械企业提供临床试验统计咨询、试验设计、数据管理统计分析与编程等多方面专业服务。团队由数十位来自国内外知名药企和临床 CRO,拥有平均十年左右行业经验的核心技术人员及专家构成。洞悉行业政策及标准,以客户需求为导向,不断优化迭代形成最佳实践和服务模式。适应不同业务需求,开创灵活创新的合作模式: 包括数统全方位大包服务、业务流程外包(FSP)、战略合作、专家咨询与培训、监督管理及人员外派。为客户降本增效,加速新药研发与上市进程。
统计分析与编程服务
有临来雅统计分析与编程团队致力于为客户提供卓越的一站式CDISC标准服务,包括将EDC系统收集的原始数据精准地转换成符合SDTM标准的数据集、生成ADaM数据集以及提供标准化数据电子递交包 (注释病例报告表、SDTM/ADaM define.XML、cSDRG和ADRG等),更好地支持临床试验注册和上市申请。有临来雅团队还可以提供其他CDISC标准实施,包括按CDASH标准设计CRF和EDC搭建、CDISC培训和策略咨询,以及基于CDISC标准的创新合作项目。