2025-04-21
有临医药

在现代医学的前沿探索中,癌症治疗领域持续涌现重大进展。免疫疗法自问世以来,为癌症治疗开辟了全新路径,而瘤内给药免疫疗法作为其中重要的一支,近年来愈发受到广泛关注。尽管瘤内给药免疫疗法并非全新概念,但其在癌症治疗中的潜力正不断被挖掘,正以全新的姿态为广大患者带来新的希望。
瘤内给药免疫疗法的原理与优势
瘤内给药免疫疗法的核心机制是将免疫刺激剂直接注入肿瘤病灶(包括原发灶与转移灶),利用肿瘤细胞自身成分作为内源性抗原,启动并增强机体的抗肿瘤免疫反应。与传统癌症疫苗相比,其无需预先确定特定分子靶点,也无需进行人类白细胞抗原(HLA)分型,具有更高的通用性。
该疗法具有多方面优势:一是能够精准提高肿瘤局部药物浓度,增强免疫治疗效果,同时减少全身不良反应;二是可特异性激活肿瘤微环境中的免疫细胞,如树突状细胞、T 淋巴细胞等,增强其对肿瘤细胞的识别和杀伤能力;三是能有效克服肿瘤异质性,直接作用于不同表型的肿瘤细胞,降低肿瘤细胞产生耐药性的风险,提高治疗的持久性;四是与化疗、放疗、靶向治疗等传统治疗方式联合应用时,可产生协同增效作用,显著提升整体治疗效果。
在临床实践中,瘤内给药免疫疗法已取得显著成果。首个获批的瘤内免疫疗法药物 Talimogene laherparepvec(T - VEC),作为一种经基因工程改造的溶瘤单纯疱疹病毒,可表达人粒细胞 - 巨噬细胞集落刺激因子(GM - CSF),在晚期黑色素瘤治疗中,显著诱导了客观的“远端效应”,延长了患者生存期。此外,其他溶瘤病毒、瘤内溶瘤肽等在多种癌症治疗中也显示出良好的应用前景。
丰富多样的药物靶点
目前,临床试验中采用瘤内递送的免疫疗法药物靶点丰富多样。免疫检查点单克隆抗体通过阻断免疫检查点信号通路,如 PD - 1/PD - L1、CTLA - 4 等,解除肿瘤细胞对免疫系统的抑制,激活 T 细胞抗肿瘤活性;Toll 样受体(TLRs)作为模式识别受体,可识别病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs),激活固有免疫细胞,启动免疫应答;干扰素基因刺激蛋白(STING)及视黄酸诱导基因 I 样受体(RLRs)参与固有免疫信号转导,促进 I 型干扰素等细胞因子的产生,增强免疫细胞活化;此外,还有细胞因子与相关因子、信使核糖核酸(mRNA)、溶瘤病毒与细菌、溶瘤肽等多种靶点,从不同层面和机制协同增强瘤内免疫治疗效果,为癌症治疗提供了更为多元化的策略选择。
瘤内注射病灶的选择
注射病灶的选择需要结合受试者临床状况,选择肉眼可见、浅表可触及或借助 CT、超声引导下的可注射病灶。至少在一个预先规定的病灶部位(包括靶病灶和非靶病灶)进行注射给药。每次注射前,都要按照注射病灶优化选择的原则重新评估,以实现受试者临床获益的最大化。若需更换注射病灶,应尽量避开基线期未注射的靶病灶,便于观察研究药物的系统性疗效。
若研究者判定最初的注射部位无法继续注射,需选择新的病灶或病灶部位进行替代。之后,只要该新部位具备注射条件,应持续使用。
当研究者认为已无可注射病灶(即病灶肉眼或影像学检查显示消失),但受试者继续接受治疗仍可能获益时,可在原注射病灶消失部位或其邻近部位继续注射给药,也可选择在肿瘤引流淋巴结内进行注射。
优化注射病灶的原则如下:
瘤内注射的给药方案的制定
瘤内注射的给药方案制定颇具挑战,需综合考量诸多复杂因素。由于肿瘤病灶体积存在较大个体差异,且不同免疫刺激产品的药代动力学和药效学特征各不相同,同时还可能面临如快速耐受性、抗药物抗体产生等问题,这些都使得给药方案的确定困难重重。
在 I 期剂量爬坡试验中,主要存在三种剂量爬坡选择策略[1]:其一,固定注射体积,通过增加药物浓度来探索合适剂量;其二,固定药物浓度,依靠增加注射体积进行尝试;其三,依据肿瘤病灶体积的实际情况来灵活调整注射体积,如图1。需要注意的是不管是固定体积或者固定浓度亦或者根据肿瘤病灶体积调整给药浓度和给药体积的实际给药剂量是固定的。无论是哪种给药方案,药物不同,人群不同最终导致局部生物利用度也会有差异,具体选择哪种给药方案需要结合药物的特性去选择。像溶瘤病毒这类治疗药物活性浓度范围较广的情况,填充注射病灶体积并依病灶大小调整注射体积是较为常用的做法。
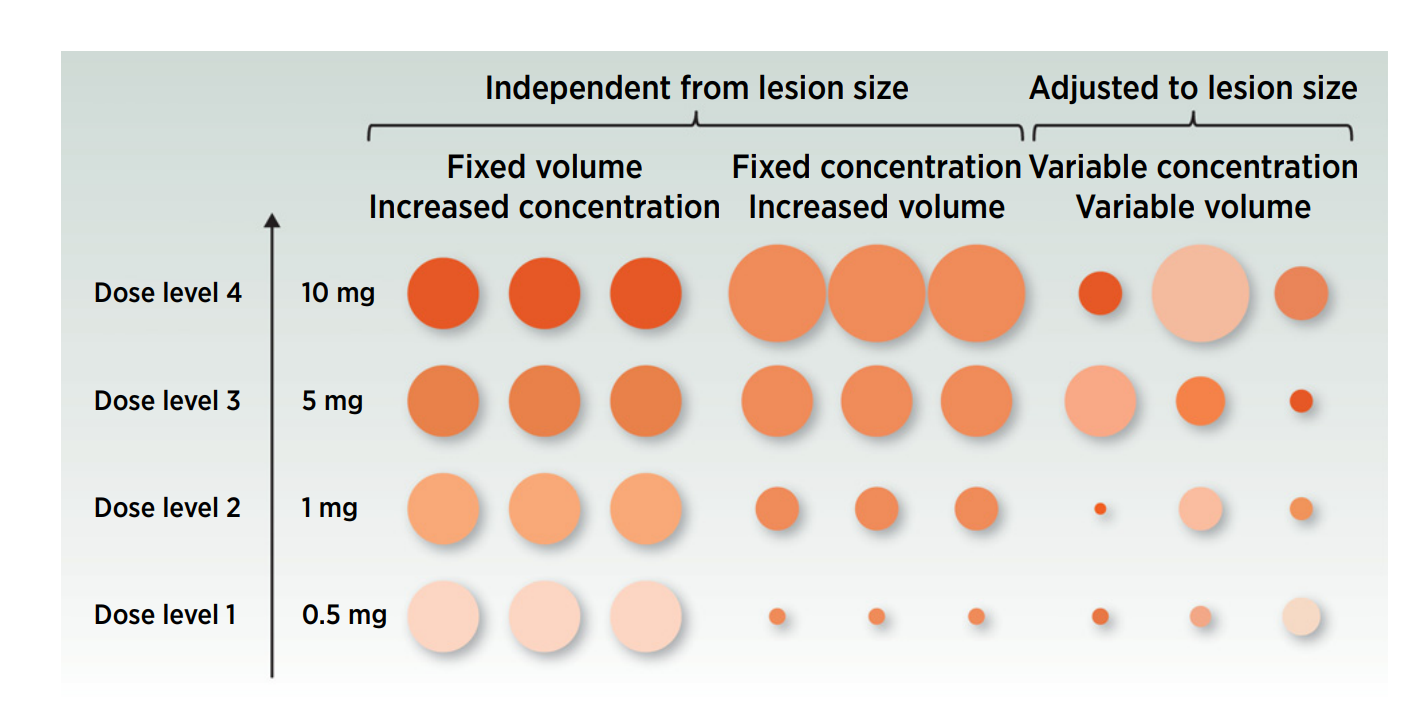
图1 I期剂量爬坡的给药方案选择
瘤内注射的疗效评估
瘤内给药免疫疗法的疗效评估不能单纯依赖传统的RECIST标准,因为免疫疗法的反应模式较为特殊,如可能出现假进展、混合反应等情况。目前,已制定了专门的itRECIST(intratumoral RECIST)指南[2],在评估疗效时,需要分别收集注射和未注射肿瘤病灶的直径信息,PET扫描等检查也有助于更准确地评估治疗效果。在治疗过程中,医护人员还需密切监测患者可能出现的不良反应,如低血压、发热等,提前做好应对措施,确保患者安全。
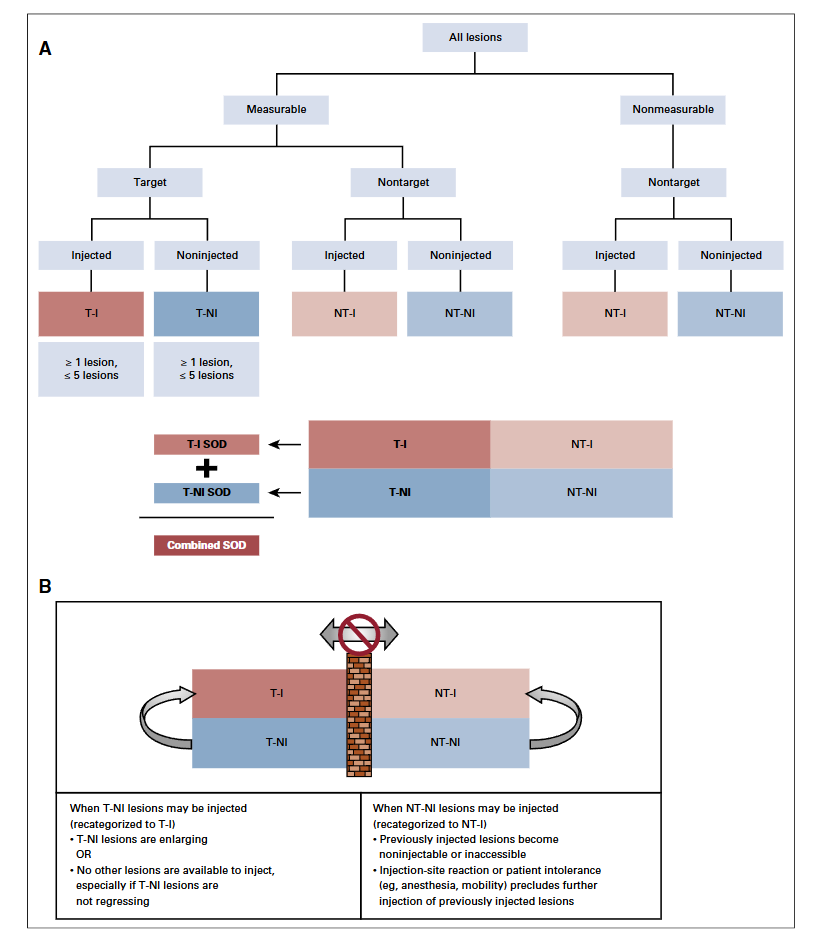
图2 itRECIST-基线的分类及基线后的重新分类
总的原则和RECIST v1.1类似(不同之处:基线期允许≤10个靶病灶,注射不影响评估,允许超声测量);总的反应包括所有靶病灶(注射靶病灶和非注射靶病灶相加SOD的与基线期和最小值比),所有非靶病灶(注射非靶病灶和非注射非靶病灶,定义为消失、存在、或明显的进展)。注射针孔的肿瘤种植灶不认为新病灶,除非后续的影像学证实增大。
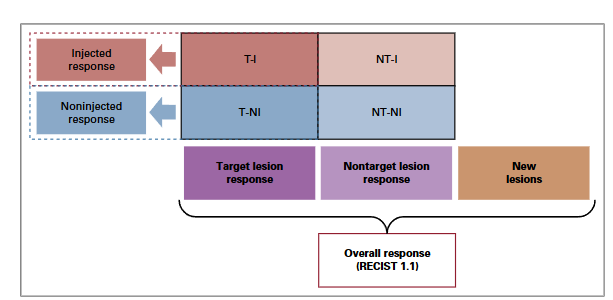
图3 itRECIST的疗效评价
所有非注射靶病灶SOD与基线期和最小值比;类似RECIST v1.1的评估。一旦非注射靶病灶被注射,认为已获得最大的注射反应,后续的非注射反应则不可评价。
每次治疗访视期,注射病灶可能改变,没有固定的基线可以比较。每一次评估时,当前的注射靶病灶的SOD和前一次注射靶病灶的SOD比,用于指导优化注射病灶。在治疗停止或中期分析期间,注射病灶的最佳反应是通过比较注射病灶最小的SOD与注射病灶第一次注射前的SOD来确定的。
注射靶病灶和非注射靶病灶的反应评估下表:
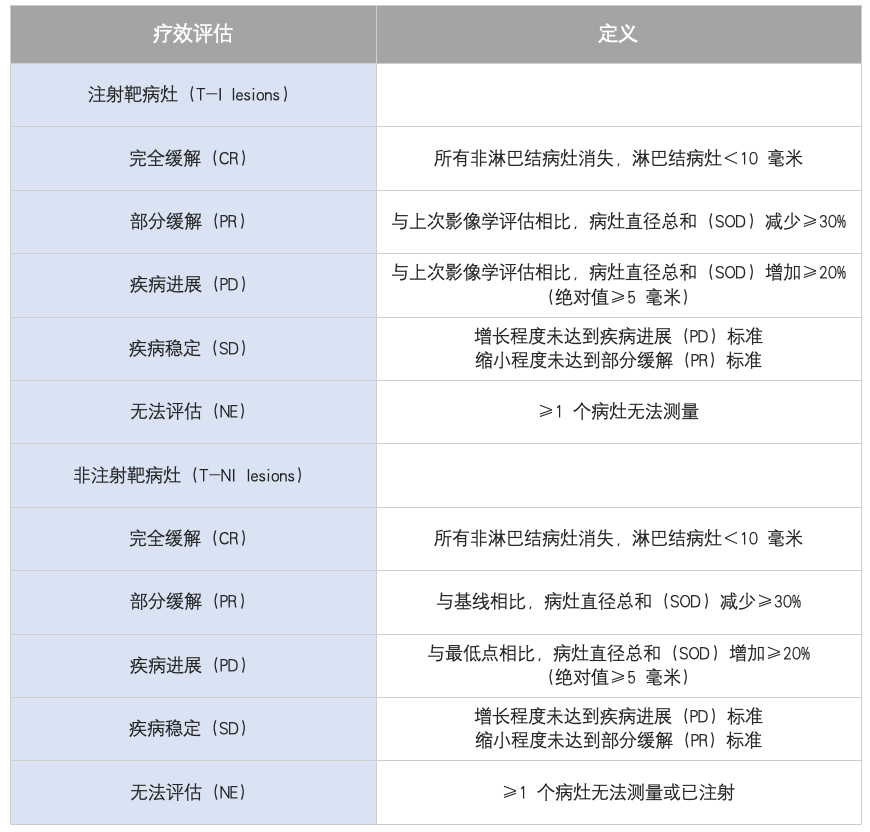
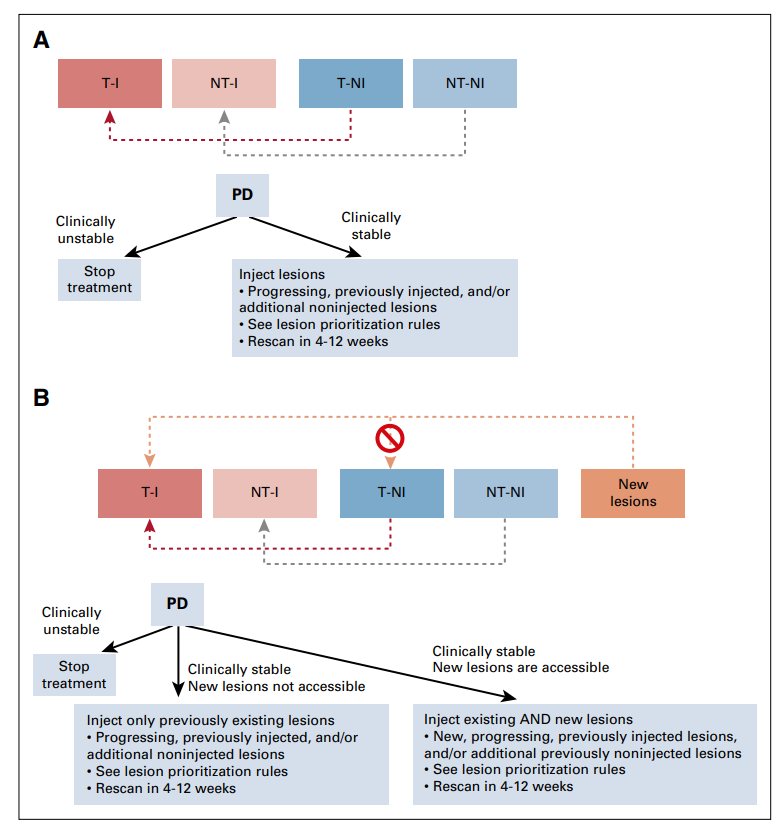
图4 itRECIST进展后的管理
药免疫疗法的应用前景
尽管面临挑战,但瘤内给药免疫疗法前景广阔。目前,它在转移性复发性/难治性癌症患者的临床试验中广泛开展,未来有望应用于局部癌症的新辅助治疗。新辅助治疗时使用瘤内免疫疗法,或许能在避免全身免疫治疗相关不良反应的同时,降低癌症复发率,比如黑色素瘤在新辅助治疗中使用瘤内溶瘤病毒或TLR激动剂后,复发率有所降低。而且,瘤内免疫疗法与放疗联合也备受关注。放疗能局部刺激免疫系统,与瘤内免疫疗法协同,有望更好地激发全身抗肿瘤免疫反应。当然,二者联合的最佳剂量和方案还需要进一步研究确定。瘤内给药免疫疗法为癌症治疗开辟了新方向,虽然还需要克服诸多困难,但随着研究的深入和技术的进步,它有望为更多癌症患者带来更有效的治疗选择,让我们一起期待这一领域的更多突破!
参考文献:
[1] Champiat S, Tselikas L, Farhane S, et al. Intratumoral Immunotherapy: From Trial Design to Clinical Practice. Clin Cancer Res. 2021;27(3):665-679.
[2] Goldmacher GV, Khilnani AD, Andtbacka RHI, et al. Response Criteria for Intratumoral Immunotherapy in Solid Tumors: itRECIST. J Clin Oncol. 2020;38(23):2667-2676.
撰写:赵瑜
审核:李晓梅