2025-04-14
有临来雅

摘要
临床试验中的方案偏离(Protocol Deviation, PD)直接影响受试者安全和数据质量。本文系统阐述了数据管理方(Data Management, DM)在PD管理中的多维角色,阐述了"可编程PD"的分类方法,并构建了PD全流程管理模型。通过EDC系统数据,DM团队可实现PD的早期识别、动态监控与风险预警,为临床试验质量管控提供多一层保障。
方案偏离管理的现状与挑战
在全球化药物研发背景下,临床试验实施过程中方案偏离常常会发生且不可避免。方案偏离关系到受试者的安全性、临床试验的数据质量(包括试验数据的真实性和完整性等)、受试者分析集划分以及临床试验结果评价。因此,试验过程中及时识别方案偏离并防止偏离继续发生至关重要。这就要求项目组能够及时获得准确清晰的方案偏离汇总、进行专业判断、和采取必要行动。方案偏离管理已然已成为临床试验质量体系的核心环节。根据FDA 2022年度报告,约23%的临床试验因PD管理缺陷导致监管质疑。传统PD识别主要依赖临床监查员(Clinical Research Associate, CRA)的现场发现,在其监查工作中发现并上报,这种被动模式存在时效滞后和识别盲区双重局限。
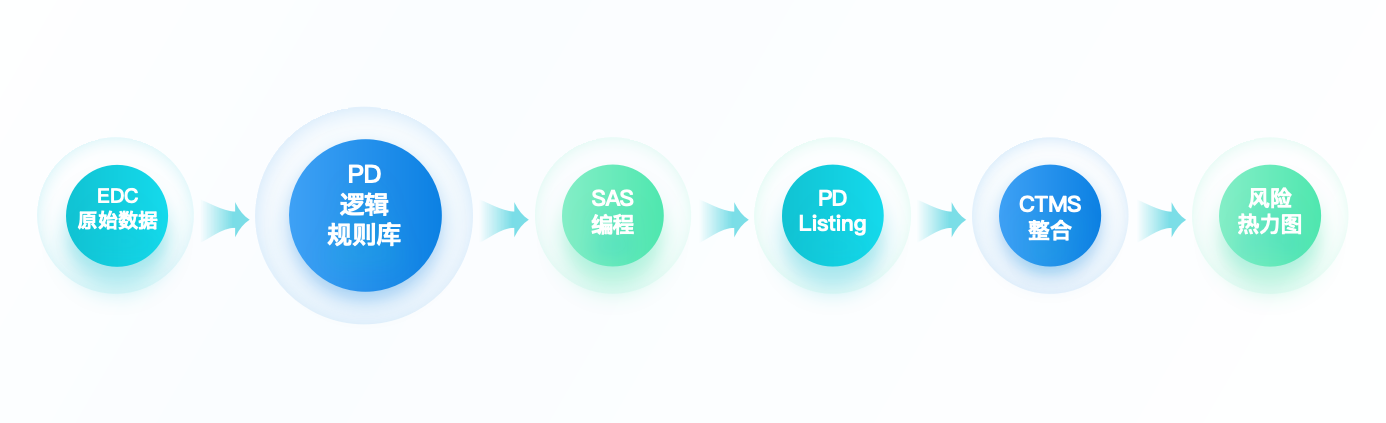
然而DM(数据管理员)作为与数据打交道最多的人员,并没有发挥应有的作用。只是对CRA发现的方案偏离数据在EDC(电子数据采集系统)中进行核实。实际上,数据管理方可以在项目中支持到更多方案偏离的相关工作。例如通过EDC数据库中收集到的数据及时发现潜在的方案偏离,合并CRA发现的观察性PD(方案偏离),反馈到项目组进行识别和防止更多类似方案偏离的发生。作为临床试验数据的"守门人",数据管理方维护的EDC系统承载着90%以上的试验数据流。DM应转型为PD管理的"主动哨兵",通过技术手段重构PD管理范式。
PD分类
首先,在临床试验启动阶段,根据该临床试验遵循的标准操作流程(SOP)要求,项目经理或医学经理会起草方案偏离管理计划,基本内容应包含如下:
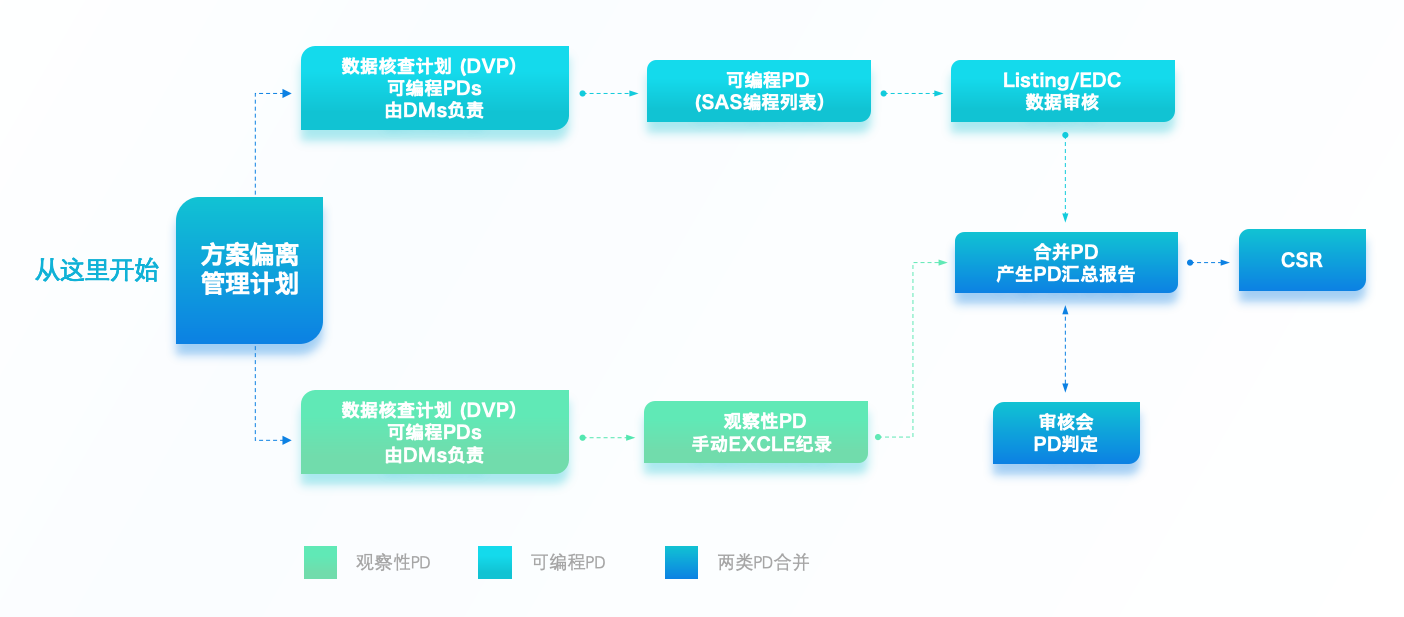
数据管理方需审核该文件,确定哪些PD对应的抓取数据是EDC中有对应收集的且可通过编程获取的。因此,我们需要明确观察性PD(Observable PD)和可编程PD(Programmable PD)的定义并对应收集。
全周期管理模型构建
启动阶段
参与制定《方案偏离管理计划》,重点审核:
一旦确定哪些为可编程PD后,数据管理方则按照该方案偏离计划撰写方案偏离编程说明。该说明将对应的逻辑转换为程序语言,提供给到程序员。
程序员再利用SAS进行PD Listing的编程,完成后提供给到DM测试。为确保程序的正确性和完整性,测试需持续直至最终该列表程序通过并能输出正确的PD Listing。
执行阶段
建立"PD月报"制度,关键指标包括:
项目运行清理过程中,DM可以定期生成PD Listing,并提供给到运营团队供其参考确认。
若项目采用了CTMS(临床试验管理系统),运营团队可以利用该系统进行合并。合并过程中可以识别是否有漏报或错报的方案偏离,是否有重复收集到的方案偏离。一一确认后将此合并的PD报告返还DM更新程序源数据,便于下一轮PD Listing的准确性。
同时,若有方案偏离审核会召开,可提供给到审核会成员进行方案偏离的判定。判定内容包括分类、严重程度等信息的敲定。审核会成员中包含医学团队,则可以从医学科学的角度判断方案偏离对受试者安全性的影响。
除此之外,对于无法确认的PD,各个职能部门都能根据确认后的PD合并表采取后续措施,例如DM在EDC中添加数据质疑确认方案偏离数据记录准确,运营协调更正中心及第三方管理工作。
锁库前期
开发PD三重验证机制:
项目接近尾声时,PD收集和确认工作以及方案偏离审核会召开频率会增加,为EDC数据库锁定前的数据审核会做准备。一旦整个试验的方案偏离信息确认后,该数据将会通过统计分析及编程进入到最终临床研究报告(CSR)中。
实证案例分析
在某III期肿瘤试验中,DM团队通过以下干预显著提升PD管理效能:
由此,我们可以看出数据管理方在临床试验方案偏离管理的工作中有至关重要的作用。数据管理的加入既能采用编程抓取PD查漏补缺,确保观察性PD的准确性,又能够及时及早的识别风险,减少偏离的发生。为确保试验执行质量和数据质量,尤其是重点关注的方案偏离,数据管理的加入必不可少。
任何临床试验中的工作都是团队合作的结果,方案偏离的管理也不例外。需要各个职能部门共同协作,确保方案偏离的及时性和准确性,减少试验实施过程中方案偏离对受试者的安全、数据质量及统计结果造成不良影响。
思考:DM角色的范式转变
文末,我们可以思考,DM深度参与PD管理可能带来三重价值:
结论与展望
建议行业建立DM主导的"智能PD监控中心",未来可探索:
参考文献:
[1]ICH E6 (R3)
[2]《药物临床试验质量管理规范》(GCP,2020年)
[3]《临床试验方案偏离处理技术指导原则》(CDE,2021年征求意见稿)
[4]TransCelerate Protocol Deviation Classification Model (2022)
[5]TransCelerate BioPharma 2021年行业基准研究"Protocol Deviation Categorization and Volume Analysis"
[6]IQVIA EDC利用率分析(2022)"Automated PD Detection in Electronic Data Capture Systems"
[7]Roche/Genentech 内部研究全球III期肿瘤试验(NCT0123456)(2021-2022)
[8]《Journal of Clinical Oncology》类似研究"Electronic Monitoring of Protocol Compliance in Oncology Trials" (2020)
[9]Medidata Solutions 技术白皮书"AI-Driven Lab Data Monitoring in Cancer Trials" (2022)
[10]某跨国III期试验使用Veeva CTMS与EDC交叉验证
[11]DIA《中心合规性监测最佳实践》 (2021)
[12]TransCelerate BioPharma的RBM(基于风险的监查)研究报告"Risk-Based Monitoring Implementation Case Studies" (2021)ACRP
[13](临床研究专业协会)白皮书"Digital Tools for Protocol Deviation Management" (2022) Tufts CSDD(塔夫茨药物研发研究中心)分析报告"Impact of Centralized Monitoring on Clinical Trial Costs" (2020)
[14]IQVIA技术白皮书"Automated Protocol Deviation Detection in EDC Systems"
[15]FDA“真实世界证据计划”合作研究"Predictive Analytics for PD Risk Identification" (2021)《Applied Clinical Trials》期刊文章"CTMS Integration Improves Critical PD Capture" (2023)
撰写:张荔
审核:张子豹