2023-05-26

溶瘤病毒(oncolytic virus,OV)疗法以其特异性复制引起癌细胞凋亡,并保留正常组织不被破坏的优势,成为肿瘤免疫治疗研究的热门赛道之一。虽然目前获批产品数量较少,但相信随着技术的成熟、适应症的拓展及临床试验的不断推进,OV疗法的未来前景广阔,一定能为更多患者重铸新生。5月24日晚,有临医药携手CMAC成功举办《溶瘤病毒的临床开发思考》直播,由有临医药中央医学部负责人姜岚女士主持,特邀有临医药首席医学官兼注册总监韩海雄博士,有临医药医学总监武亚玲博士及有临医药高级药理研究员谢珊珊博士作相关专题分享。

TOPIC 1 溶瘤病毒的注册要求考量

韩海雄博士
有临医药首席医学官兼注册总监
溶瘤病毒的临床应用广泛,除实体瘤和血液肿瘤领域,药物(包括与放化疗、免疫检查的抑制剂药物等)的联合应用能发挥出更为强大的双重作用,这也将在未来成为更有潜力的大趋势。韩海雄博士从溶瘤病毒的概况出发,为大家深度诠释了中美欧监管体系与溶瘤病毒注册的相关指导原则,以及如何从多学科注册角度去思考。
开发/注册策略贯穿生命周期全过程

TIPS:与监管早期及关键节点的沟通交流
产品复杂,毒性担忧;基于产品及适应症的加速审批潜力
注册的三个重要考量点
一、CMC考量及关注点
1. 生产物料:病毒种子库、生产/包装细胞及其它生产物料的来源
2. 生产工艺:工艺研究与开发与稳定性,最终工艺需匹配临床应用,对于临床前产生变化的工艺及时干预调整
3.产品质控:了解质量控制规范,与临床给药方案及用药实操相结合,保证结果的稳定性
TIPS:在FIH之前尽可能多的解决CMC相关问题
识别和控制风险,工艺变更尽可能与临床试验的开展相结合
二、非临床考量及关注点
确定预期产品的生物活性状态及综合考虑产品有效剂量的大致范围,提供明确的数据以证明人体使用的安全性,为临床试验设计提供参考,支持获益预期和风险评估
关注点:概念验证试验(药效学)、动物模型及种属选择、安全性、GLP依从性
三、临床考量及关注点
早期探索性的临床试验:确定起始剂量,伴随治疗及毒性特征
确诊性临床试验:沟通关键参数(适应症选择、品牌标准剂量及终点、疗效安全性评估) 针对CGT药物,我国监管机构也有一定政策扶持,可考虑应用灵活可行的临床开发方法,例如适应性设计、新的临床终点、新颖的统计学方法、加快上市注册程序及非传统的临床开发路径及工具。
关注点:
1.联合疗法:合理性依据及相对充分的单药临床数据
2.IIT:工艺稳定性、GCP符合性、数据可靠性
TIPS:临床开发策略,试验设计,试验质量 考虑临床价值、患者需求、差异化开发如适应症的选择、运营/申报能力等。
TOPIC 2 溶瘤病毒的临床开发策略考量

武亚玲博士
有临医药医学总监
透过最新临床数据与研发进展,武亚玲博士多角度研判与解读了目前的产业发展趋势,并结合各适应症的诊疗指南及管线布局、上市需求及销量等,就溶瘤病毒的适应症、给药方案、风险控制等方面做了多维度的详细介绍。
目前,溶瘤病毒主要的临床分期主要集中在∣期、∥期探索性的阶段,86%的给药方式是瘤内注射,适应症以黑色素瘤的临床实验占比最多,少量乳腺癌、头颈鳞癌及肝癌,市场处于逐渐成熟的过程。由于消除肿瘤细胞的机制与其他抗癌疗法明显不同,所以OV是与大多数其他治疗方式相结合的合理选择,例如联合PD-1、化疗或CAR-T等治疗方式。
一、溶瘤病毒临床开发策略的考量点
•梳理自身特点及亮点:病毒载体、插入的基因、给药途径、生物分布等
•对标产品的适应症,寻找差异化:适应症人群/治疗线数,给药频率/途径/方案,临床研究的分期及疗效结果,联合用药,生物标志物,安全性数据/PK数据/ADA数据等
•疾病领域的临床需求:CSCO指南、NCCN指南等,流行性病学,沟通PI
•细节考量:注射难度、肿瘤负荷
二、溶瘤病毒在头颈鳞癌中临床开发策略建议

三、总结
1. 适应症
•明确试验药的特点及亮点
•对竞品及现有治疗的关键数据进行梳理
•结合各适应症的诊疗指南及管线布局、上市需求及销量等综合考量适应症
•能单臂就单臂,不能单臂尽快探索联药
2. 给药方案
•给药途径:瘤内注射还是静脉注射?还是瘤内注射+静脉注射?可能需要探索
•给药频率:Q2W?Q3W?可能需要探索
•给药剂量:对溶瘤病毒并非剂量越高越好,需要探索
3. 风险控制
•溶瘤病毒引起高热比较常见,其他AE也需要收集
•对病毒脱落需要密切监测,此为CDE指导原则的要求
TOPIC 3 溶瘤病毒的临床药理考量

谢珊珊博士
有临医药高级药理研究员
临床药理研究在药物研发中至关重要,通过对溶瘤病毒的介绍、在临床病理中的考量及经典案例分享,谢珊珊博士对如何优化给药方案等来引导药物提速开发作了全面解读和经验分享。
一、溶瘤病毒人体首次给药剂量考量
科学论证
在临床试验开始前,应在作用机制、有效剂量范围、量效关系、耐受剂量、毒性反应特征、种属差异、给药途径、适应症、拟用药人群等方面完成科学论证。
种属转化
根据非临床研究所提示的安全有效性特征,生物学作用和组织分布差异特点,基于现有的非临床数据,进行动物剂量与人体等效剂量的种属间换算,确定首次临床试验起始剂量。
* 如脑瘤内给药可以采用脑体重、或者脑体积进行等效剂量换算,系统给药一般采用体表面积比估算。
二、溶瘤病毒临床给药策略考量
•给药策略:从肿瘤内注射开始,逐步进行区域或局部给药,然后进行全身给药
•给药途径:主要包括瘤内注射和静脉内注射
•使用剂量:建议根据肿瘤体积大小及病灶数量,参考相关产品的说明书和临床证据决定使用剂量
•给药频率:溶瘤病毒种类、药物特征、治疗目的等因素会影响给药频率
三、溶瘤病毒的药代动力学探索性研究
常规检测
临床研究阶段建议进行药代动力学研究,包括生物分布、病毒排出等内容。应该从病毒的生物学特性,包 括复制能力、免疫原性、持续性和潜伏期、靶向性、减毒产 品的稳定性等,以及药物给药途径来考虑。
监测分布
建议关注临床样本采集方式、样本采集频率和监测周期的持续时间。由于给药后病毒在某些组织中进行复制,应设计足够的监测频率和持续时间。如果溶瘤病毒表现出潜伏再激活,其探索性研究的持续时间可能更长。
五、溶瘤病毒的药效探索性研究
活检
鼓励在合适的时间点,在征得受试者知情的前提下,通过活检的方法采集标本,检测肿瘤组织中的各项指标。
生物标志物
鼓励进行疗效相关的生物标志物的探索。预测性生物标志物考虑要素:肿瘤的内在特征、免疫相关特征和系统特征。
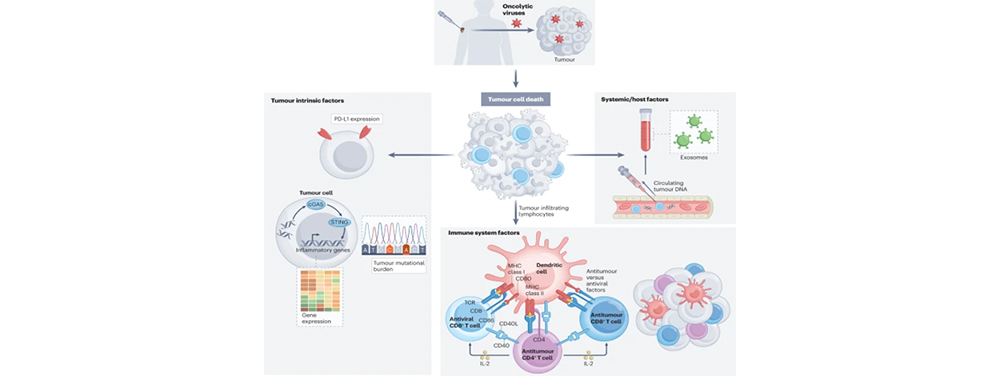
溶瘤病毒生物标志物的探索
文献来源:Shalhout et al., 2023
六、定量药理在溶瘤病毒研究中的应用
•除了典型的清除途径,许多因素影响患者的OV滴度,如宿主产生的中和抗体、肿瘤细胞吸收病毒的效率以及随时间变化的肿瘤负担,这些都使得传统的PKPD分析变得困难
•描述OV PK,可以使用微分方程来模拟OV和肿瘤细胞之间的动态相互作用。
这些模型为OV在注射部位以外的生物分布、不同剂量下随时间的预测病毒滴度,以及OV再给药的最佳时间