2025-04-14
临影医药

PET成像:静态与动态的本质差异
PET(正电子发射断层成像)通过追踪放射性示踪剂(如¹⁸F-FDG)在体内的分布,揭示代谢活性。传统静态成像在注射示踪剂后固定时间(如60分钟)采集图像,以“标准化摄取值(SUV)”反映局部代谢强度。SUV虽直观,但存在明显局限:
动态成像则通过连续采集示踪剂从注射到代谢的全过程数据,结合数学模型计算定量参数,揭示代谢通路的真实速率。例如,肿瘤的高SUV可能源于血流增加(K1↑)或磷酸化滞留(k3↑),动态成像可区分二者,避免误判[1]。
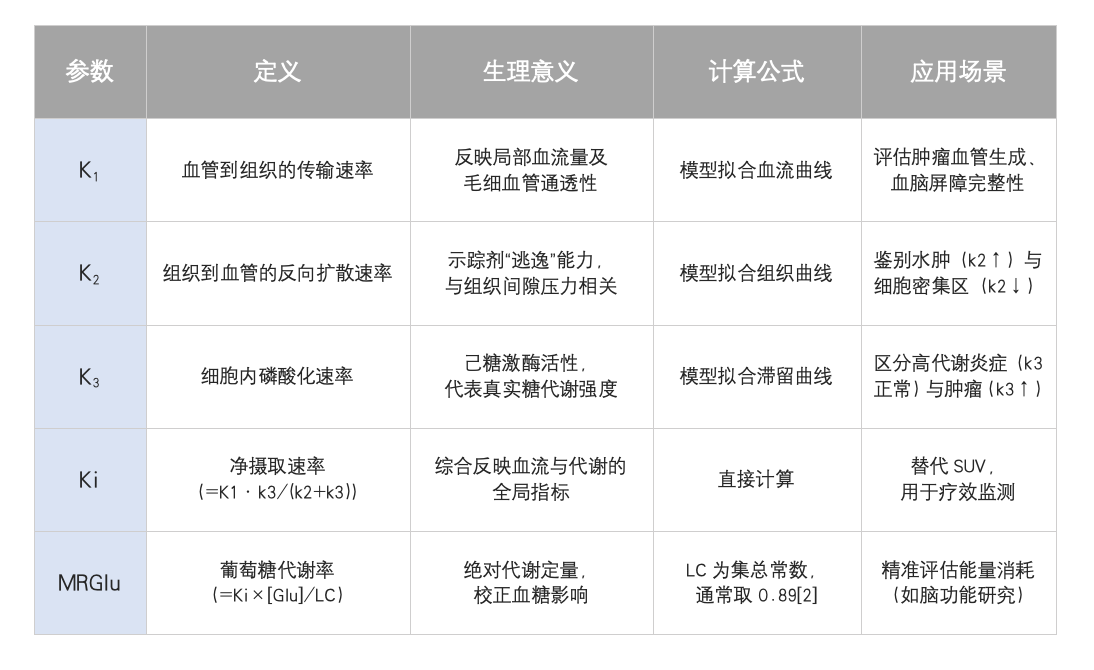
动态PET的核心定量参数:意义与计算方法
动态成像需基于房室模型(Compartment Model)解析示踪剂动力学。以¹⁸F-FDG为例,其代谢路径可简化为:
血管→组织间质(速率K1,反向k2)
间质→细胞内磷酸化(速率k3,不可逆)
由此衍生以下关键参数:
长轴动态显像:技术突破与药研价值
传统动态PET采用短轴扫描(覆盖20-30cm),仅能监测单一器官(如心脏)。长轴PET(覆盖100-200cm)通过连续床位移或宽探测器设计,实现全身动态成像,优势显著:
新药一期试验需评估多器官摄取(如抗癌药的肿瘤靶向性与肝毒性)。长轴PET可同时获取心脏(血流输入函数)、肿瘤(药效)和肝肾(毒性)的时-活曲线,减少多次扫描误差[2]。
短轴扫描需假设外周组织的输入函数与心脏一致,而长轴直接测量各区域动脉输入,避免误差。研究显示,长轴动态的Ki误差较传统方法降低40%[3]。
针对快速代谢药物(如¹¹C标记化合物),长轴成像可在单次扫描内完成全身动态数据采集,避免半衰期限制。
阿斯利康在PD-L1抑制剂研发中,利用长轴动态PET量化药物在肿瘤与脾脏的K1/k3比值,成功筛选出高靶向-低脱靶毒性的候选分子[4]。
主要参考文献:
[1] Cherry SR, et al. Physics in Nuclear Medicine. 5th ed. Elsevier; 2021.
[2] Wong KP, et al. EJNMMI Phys. 2020;7(1):1-15.
[3] Feng T, et al. J Nucl Med. 2021;62(3):393-399.
[4] Smith DA, et al. Clin Cancer Res. 2022;28(10):2029-2037.
撰写:芦鑫淼