2025-02-14
有临医药

系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种复杂的系统性自身免疫疾病,B细胞异常和自身抗体的产生在其病理过程中具有重要作用,SLE的病因源于自体反应性B细胞的过度活化,导致浆母细胞和长寿命浆细胞产生针对dsDNA和核蛋白自身抗原的自身抗体,形成免疫复合物,沉积在多个器官和组织中。长期以来,SLE 的治疗主要使用糖皮质激素、抗疟药(通常为羟氯喹)和免疫抑制剂(如硫唑嘌呤、甲氨蝶呤、霉酚酸酯和环磷酰胺),生物制剂(贝利尤单抗或利妥昔单抗等)也被推荐用于SLE治疗,但这些治疗并不能治愈SLE,在部分重度和难治性患者中效果非常有限。越来越多的研究表明,SLE治愈核心在于安全、彻底地清除病理性B细胞,调节SLE患者自身免疫微环境,清除自身抗体,达到长期改善临床症状的目标。
CAR-T能够通过表达CD19 CAR特异性杀伤B细胞,从而有望达到深度清除SLE致病性B细胞的效果,触发免疫“重置(reset)”,完全缓解SLE疾病。
CAR-T疗法用于SLE的分子机制
B细胞是致病性抗体的来源,naïve B细胞可以分化为浆母细胞和长寿命浆细胞,其中naïve B细胞和浆母细胞表达CD19,长寿命浆细胞表达BCMA。临床前研究SLE小鼠模型揭示,靶向CD19的CAR-T细胞能够有效预防和缓解小鼠的SLE表现。CAR-T通过深度清除病理性B细胞实现SLE患者的免疫重置,主要作用机制有以下几点:
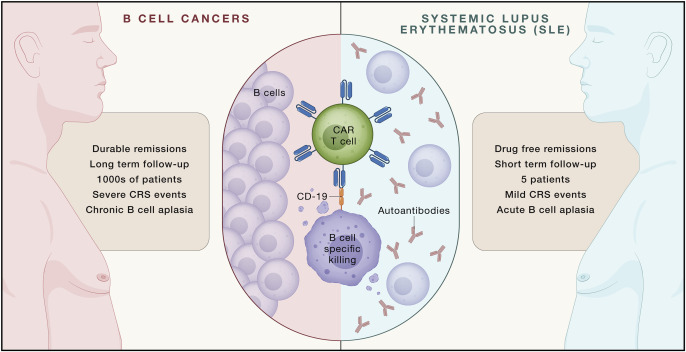
CAR-T细胞疗法用于SLE
CAR-T疗法用于SLE的疗效
2021年,领衔的研究团队首次报道了CD19 CAR-T细胞疗法在SLE患者中的应用,截止目前已经有许多研究报道了CAR-T细胞疗法用于SLE的疗效,详见表1;数据表明CAR-T用于SLE具有良好的疗效。目前中国已有30余种靶向CD19的CAR-T药物用于治疗SLE,研发最快的处于I/II期。
CAR-T细胞治疗SLE后的无药物持续缓解时间有待确定,SLE患者B细胞常在数月后发生重建,B细胞的持续和稳定再生表明CAR-T细胞的长期存在可能性不高。并且,在新发感染或接种疫苗后会发生新的B细胞增殖和成熟,可能刺激产生自身抗体的B细胞再次产生并激活,导致疾病复发。虽然CAR-T细胞的持续存在可能有助于抗体转阴,但长期B细胞耗竭也会影响免疫功能。因此,需平衡CAR-T细胞的存续时间与B细胞耗竭的风险,从而优化疗效与安全性。
疗效生物标志物:除了传统的疗效评估指标(如SLE中抗双链DNA抗体水平),还存在CAR-T细胞治疗特异性疗效监测标志物。输注前,初始T细胞和中央记忆型T细胞的高比例表达,可提示更强的抗肿瘤效应,可尝试将此应用于自身免疫性疾病领域。输注后,外周血B细胞的动态变化可评估B 细胞的清除时间;重建B细胞的免疫表型也可提示其清除深度及免疫重建程度。此外,早期记忆分化相关转录因子(如T细胞因子7、淋巴增强子结合因子)、T细胞激活标志物(如CD25、CD69、CD137)以及耗竭标志物(如CD57、PD-1、Tim-3)可用于评估患者对治疗的敏感程度及T细胞的杀伤能力。
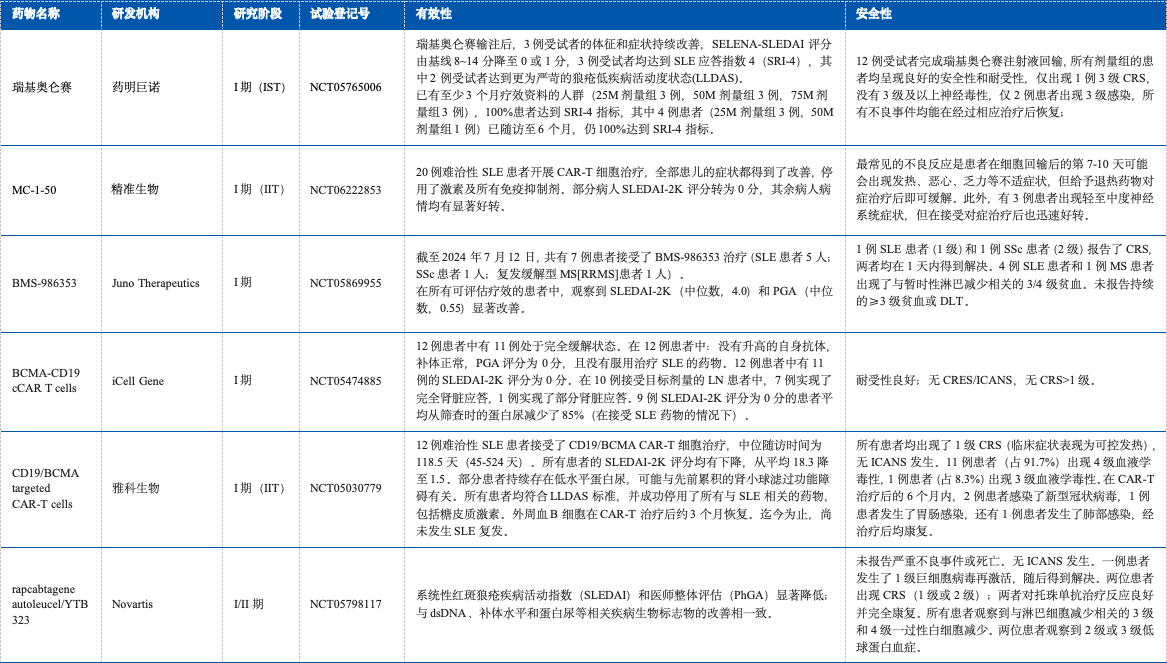
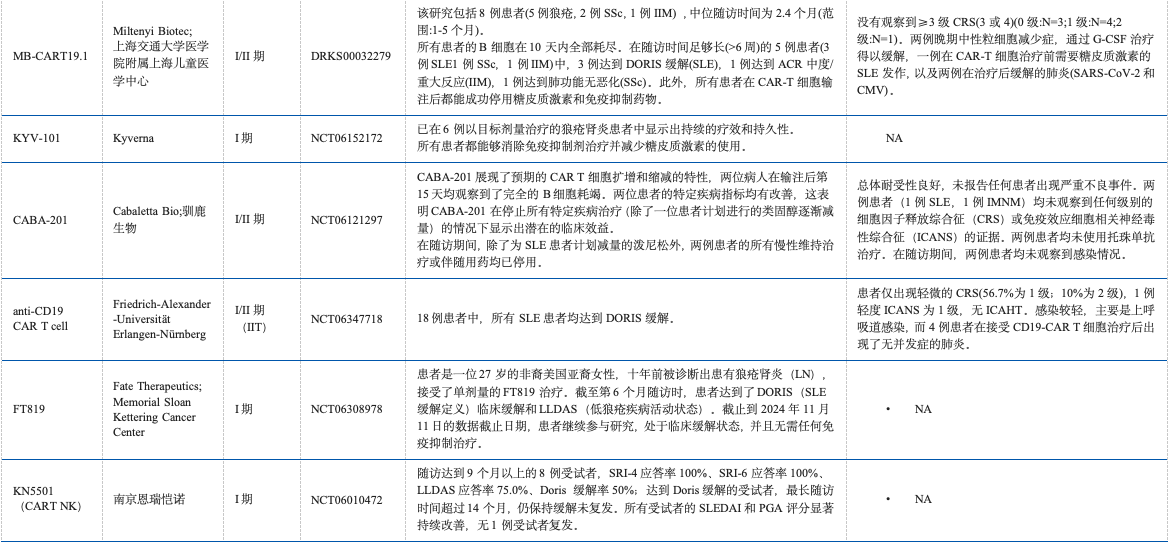
表1 CD19 CAR-T 细胞疗法用于SLE主要研究结果
CAR-T疗法用于SLE的安全性
与复发性或难治性血液系统恶性肿瘤患者相比,自身免疫性疾病患者死亡率相对较低,风险收益需更准确衡量。在血液肿瘤领域,相关不良反应包括CRS、ICANS、免疫效应细胞相关血液毒性(ICAHT)、感染及继发性肿瘤等。在目前报道的接受CAR-T细胞治疗的自身免疫性疾病患者中尚未观察到严重不良事件,常见的AE有1级CRS、1级ICANS、任何级别的血液学毒性及感染,详见表1。
CRS
尽管SLE患者在接受CAR-T细胞输注后,仅个例患者报告3级的CRS事件,但仍有相当比例的患者出现了1~2级CRS。CAR-T细胞在进入体内循环后,通过其表面表达的CAR受体与目标抗原结合,所释放的细胞因子可以引发炎症反应,激活内皮细胞、巨噬细胞、树突状细胞和B细胞等内源性免疫细胞。这些被激活的细胞会进一步释放大量促炎细胞因子和趋化因子,可能导致免疫系统过度激活、内皮损伤以及血管通透性增加。监测患者的生命体征以及血清炎症相关标志物,如C反应蛋白、铁蛋白、乳酸脱氢酶等,可以在一定程度上了解接受CAR-T细胞治疗患者的炎症状态。
ICANS
ICANS是CAR-T细胞治疗的另一个潜在不良事件,往往具有自限性。ICANS通常发生在CRS之后,但与CRS的严重程度无关。ICANS发展的机制尚不清楚,但可能与T细胞活性或细胞因子释放有关。ICANS的症状差异很大,包括谵妄、癫痫样活动、意识模糊、说话和理解困难、失语症等。使用托珠单抗治疗神经功能障碍患者的CRS时应谨慎,因为这种药物可能会暂时加重他们的症状。这部分患者可能更适合皮质类固醇。
ICAHT
血液学毒性,如贫血、血小板减少症和白细胞减少症,导致低丙种球蛋白血症,与CAR-T细胞治疗有关。
感染
CAR-T细胞输注后8周内感染最为突出,感染发生率随时间延长而下降,可维持至治疗后1~2年。CRS反应期合并感染的死亡率高。为了降低与严重低丙种球蛋白血症相关的感染风险,可以使用静脉注射免疫球蛋白。
第二肿瘤
2023年11月,在美国食品药品监督管理局不良事件报告系统(FAERS)数据库的8000条总记录中报告了22例第二原发性恶性肿瘤病例,包括T细胞淋巴瘤、T细胞大颗粒淋巴细胞增多症、外周T细胞淋巴瘤和皮肤T细胞淋巴瘤。2024年1月,美国食品药品监督管理局生物制品评估和研究中心(CBER)主任建议,CAR-T细胞疗法风险效益在肿瘤学中没有问题,针对自身免疫性疾病的CAR-T细胞疗法的研发项目应该向前推进。截至2024年4月,欧洲药品管理局已调查了38例T细胞淋巴瘤或白血病病例。欧洲药品管理局指出,全球有40000多例患者接受了CAR-T细胞疗法。迄今为止,在SLE等自身免疫性疾病中尚未报告恶性肿瘤病例。美国食品药品监督管理局目前要求对所有参加CAR-T细胞试验的自身免疫性疾病患者进行15年的随访。
综上,SLE发病机制的复杂性为开发治愈性疗法带来了挑战。B细胞在SLE的发病机制中起着关键作用,自身抗体的产生在临床症状出现前许多年就已开始。CAR-T细胞疗法影响了免疫反应的多个方面,呈现深度且持续地消除表达目标抗原的B细胞并重置免疫系统的能力,在重度、难治性SLE患者中成功诱导了持续性的无药物缓解,具有深度免疫重建的潜力。CAR-T细胞疗法帮助重新构建了传统方法,从仅仅抑制疾病转变为可能治愈疾病。然而,CAR-T细胞疗法在SLE和恶性肿瘤的应用场景存在差异,迫切需要寻找更多手段以理解和预测该疗法在SLE中的治疗进程。随着CAR-T疗法在治疗自身免疫性疾病中的发展,有效的毒性监测对于优化治疗的安全性和有效性至关重要。
参考文献:
[1] Food and Drug Administration. Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products. Available online: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-developmentchimeric-antigen-receptor-car-t-cell-products (accessed on 3 August 2024)
[2] European Medicines Agency. Pharmacovigilance Risk Assessment Committee (PRAC). Available online: https://www.ema.europa.eu/en/committees/pharmacovigilance-risk-assessment-committee-prac (accessed on 11 April 2024).
撰写:李晓梅