2025-02-06
如初
放射科和放疗科都会在醒目位置标有注意辐射危害的示警牌,但在医院的架构上,这两个科室有着完全不同的功能,而且辐射的程度也不同。
一般放射科里只有普通X光机和电子计算机断层扫描(Computed Tomography,CT)机才会由X光管产生X射线,形成辐射性物质。X光管中有一个阴极(cathode)产生电子,并在高压电场的作用下电子加速,以极快的速度撞向金属靶(target)。当电子受到靶阻挡减速时,会释放出多余能量,即X射线,它的本质是电磁波。能量通过波或粒子的形式发生转移就是辐射。根据能否使物质的原子或分子电离形成带电粒子,可以将辐射分为电离辐射和非电离辐射两大类。
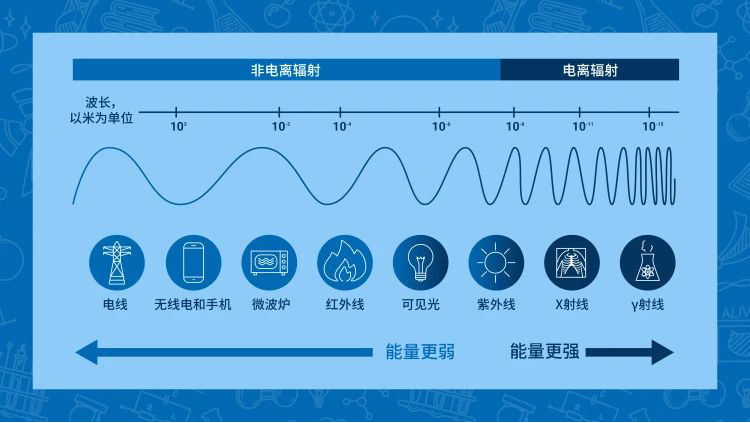
图1:辐射的种类
电离辐射具有波长短、频率高且能量高的特点,X射线便是其中之一。人体中密度较高的组织会吸收较多的X射线,密度较低的组织则相反,被吸收掉的X光不会使得底片曝光,因此呈现浅色。故而,密度不同的组织在成像板上会显现出深浅不同的影像。例如人体的肺,在正常情况下,由于肺中吸入的空气,属于密度较低的组织,因此拍摄X光片时,会呈现出黑灰色阴影。但当肺炎发生时,由于肺部气体明显减少,液体增加,导致X光不易透过。尤其肺炎严重时,底片的曝光会大量减少,形成的影像被俗称为“大白肺”。因此,放射检查可以为诊断提供依据。
放射科的作用是成像检测,一般性检查的辐射量较低。医学上通常采用毫西弗(mSv)来衡量发出的辐射剂量。我国现行辐射防护的基本剂量限值规定:每年不超过50mSv的剂量,是人体可承受(可修复)的安全范围。一次胸部X光检查大约是0.02mSv,CT检查一次约为2-15 mSv,与CT机性能、扫描部位及成像的清晰度有关。我们不必谈辐射就“色变”,辐射对于健康产生的影响,与接触到辐射时的距离、时间长度和剂量等因素均有关,一般接受检查所遭受到的辐射都在安全范围内。
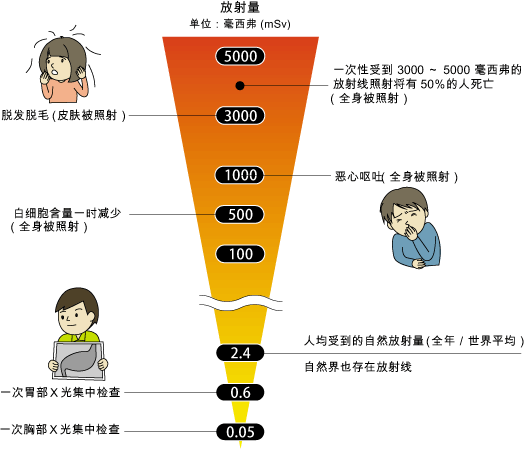
图2: 辐射剂量与安全性
同属于电离辐射的还有γ(伽马)射线、α粒子和 β粒子等,它们是放射性原子衰变时释放出的能量。医学上用射线在人机体内引发电离作用,主要为破坏细胞内的DNA链,阻止细胞分裂增生并致其死亡,称为放射性治疗,是治疗恶性肿瘤的重要手段之一(见《癌症的放射治疗》链接https://mp.weixin.qq.com/s/ZlOpwpBzKmGUwXTvM_DzOA)。但治疗恶性肿瘤需要较大的放射剂量,一般以戈瑞(Gy)为单位(1Gy=1000mSv)表示机体接受到的辐射量。常规放射性肿瘤治疗,病人每天需要接受到1.8-2.0Gy剂量,整个治疗周期可能要接受到几十个Gy的辐射量,远远超过了放射科检查剂量。利用辐射开展治疗的科室就是放疗科,它除了治疗疾病,还需满足辐射防护的要求。不仅要具备能安全配制、存放放射性物质的空间,还要有处理各种带有辐射性废料的方法,避免周边环境受到辐射影响。放疗科还有些专有放疗设备。以伽马刀为例,它利用钴-60(60Co)在β衰变过程中,释放出高能的高速电子和两束γ射线开展治疗。瑞典神经外科医师雷克塞尔(Lars Gustaf Fritiof Leksell)设计的伽马刀将约两百个60Co射束排成一个半圆形的阵列,聚焦放射线的能量于一点上。这样每个射束的能量都很低(路径损伤小),位于焦点处(肿瘤部位)的能量却极高,可减轻对肿瘤周围健康细胞的损害。像伽马刀这类通过专有仪器在体外进行辐射治疗的,被称作“外照射”。“内照射”放疗则是将放射性核元素永久或暂时植入患者体内进行治疗。例如甲状腺细胞有特异性摄取碘(I)的功能,给病人服用放射性碘-131(131I)后,它就会相对集中在甲状腺细胞内,通过衰变释放出的高能β粒子,不仅可以破坏邻近(影响半径约3毫米)细胞,达到治疗甲状腺癌或甲亢的作用,而且基本不损害其他健康组织/器官。内照射疗法还可将放射源置于肿瘤附近,如在腔内置入带有铯-137(137Cs)的器械以治疗宫颈癌等,也可达到局部接受辐射的效果。用直径20至40微米的微球包裹放射性物质钇-90(90Y)是另一类内照射方法,治疗时通过介入的方式经肝动脉将微球注入肝癌肿瘤的微血管中,90Yβ衰变产生的β粒子仅影响周边约1cm的范围,可较为精准地杀灭肝癌细胞,而几乎不影响肿瘤外的正常细胞。
由此可见,增加对肿瘤组织杀灭的精准性,提高使用安全性是放射治疗的关键。对此,靶向放射性治疗(Targeted Radionuclide Therapy ,TRT)给出了一个重要解决方案。其原理类似于ADC药物(见《ADC药物:化疗药的前世、今生和未来》链接:https://mp.weixin.qq.com/s/73PrfdOUzCiXaK4bwnqxrQ)。偶联核药(Radionuclide Drug Conjugates,RDC)由起靶向定位作用的小分子或多肽(Ligand)、连接臂(Linker)、螯合物(Chelator)和放射性同位素(radioisotope)四个部分构成。
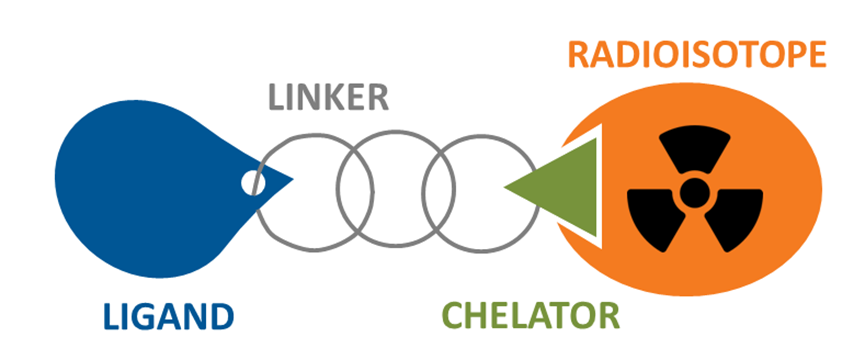
图3:RDC结构示意图
Ligand靶向病变细胞的受体或识别标记,将radioisotope带到病变细胞上(或附近),以辐射杀死病变细胞,是这类放射性药物的作用机制。这种通过将放射性同位素与靶向分子结合,直接靶向并杀灭肿瘤细胞的核药(Radiopharmaceuticals)成了最新大热的研究方向。
治疗用靶向核药主要研究的重点是:选择合适的放射性元素、靶向策略和控制释放。除前面提到过的γ射线和β粒子外,放射性元素释放的α粒子因其粒子质量更大,杀伤能力更强,但穿透性较弱的特点备受重视。如果设计成功,将有可能实现安全性更高,副作用更小,更高强度的治疗效果。常见能释放出α粒子同位素有:锕-225(225Ac)、铋-213(213Bi)、铅-212(212Pb)和钍-227(227Th)等。目前约有20多个可释放α-粒子的RDC正处于临床试验阶段中,进展最快的是百时美施贵宝公司(BMS)的RYZ101(含225Ac)靶向SSTR2(治疗神经内分泌瘤和诸多实体瘤的重要靶点)已进入了III期临床试验阶段。但目前已上市的治疗用RDC仅有诺华制药公司获批的,以释放β粒子的镥-177(177Lu)为核素的产品:Pluvicto®(治疗去势抵抗性前列腺癌)和Lutathera®(治疗胃肠胰神经内分泌肿瘤和神经内分泌肿瘤)。这两个核药在治疗过程中还可以同时进行诊断,将放射科和放疗科的功能结合起来,实现诊疗一体化。以Pluvicto为例,它是先利用治疗型核药示踪,显示出病灶位置、密度和大小,以及其目标靶点的表达情况,计算出给药后的吸收剂量。治疗后还能再次用同样的方法进行检测,以评估治疗效果。该药上市 2 年内销售额就直逼 10 亿美元,成功点燃各大制药公司对靶向核药的开发热情,吸引了众多投资者。
但靶向核药的研发需要由放射药学、化学、医学物理学和临床等多个学科的通力合作,被称为“高壁垒产业”,面临极大的挑战。由于生产和实施过程复杂,即使研发成功,放射性同位素的生产、质量控制、特殊设备的维护以及专业人员的培训等等都需要有较高的前期投入。此外,高昂的靶向核药治疗费用也会给病患带来沉重的经济负担,如Pluvicto单剂(200 mCi)约为4万2千美元。不过,核药以独特的诊疗优势与已上市核药出色的临床和市场表现,开启高增速的成长型赛道。目前国内已有多家大型医院,将放射科和放疗科整合成新型核医学科,以迎接靶向放射性治疗全面开花的局面。
主要参考文献:
[1] 国家市场监督管理总局. 《放射性药品管理办法》 [EB/OL]. 2022年3月29日《国务院关于修改和废止部分行政法规 的决定》第三次修正.
https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/bgt/art/2023/art_6235fe0dd35344e5baedfb333789198d.html
[2] Dhoundiyal et al. Radiopharmaceuticals: navigating the frontier of precision medicine and therapeutic innovation. European Journal of Medical Research (2024) 29:26 https://doi.org/10.1186/s40001-023-01627-0
[3]国金证券:重磅药Pluvicto开启RDC 新时代,核药赛道风起时.2024/09/25
撰写:如初