2024-04-29
有临来雅
抗肿瘤药物临床试验多年来一直是重点领域。由于该领域的数据特征,相应统计分析方法的应用、统计分析软件实现(如SAS和R),以及前期数据集的准备(如SDTM和ADaM)都是行业关注热点。本系列文章尝试从实际工作出发,从数据集准备开始,然后逐个环节及评估指标介绍,一直到统计分析方法描述和最终统计图表生成。本文为该系列首篇,侧重于实体瘤疗效评估统计分析方法,尤其在早期临床试验中的应用。
01. 肿瘤试验数据流程和分析数据集准备
早期实体瘤临床试验常见肿瘤相关的原始数据(raw data)集包括靶病灶、非靶病灶、新病灶和肿瘤总体评估数据集,经过数据整合及逻辑处理最终生成疗效分析图表前的分析数据集。数据整合流程如下:
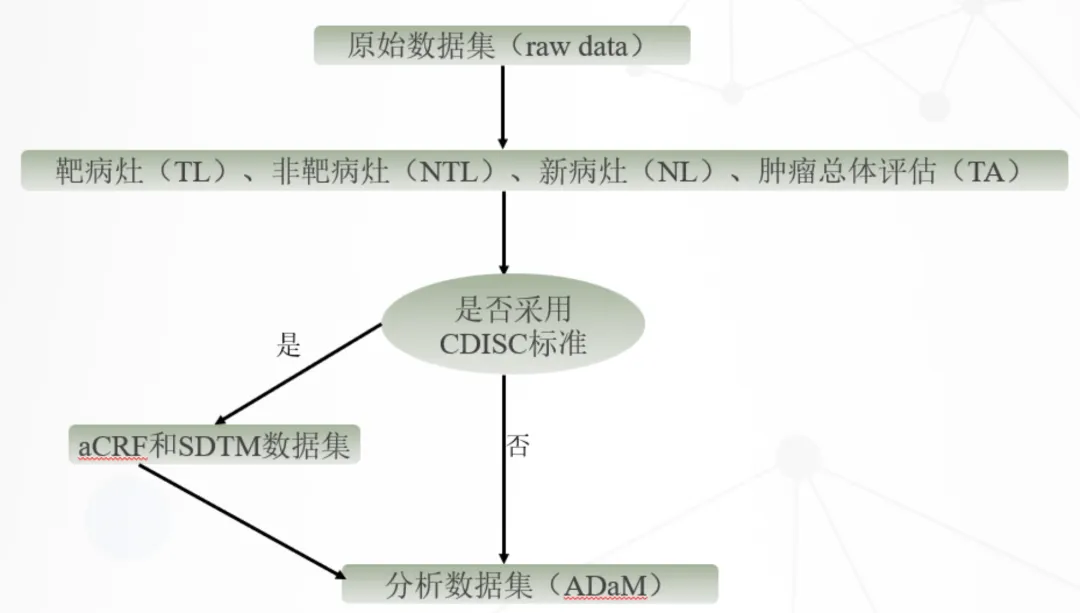
《药物临床试验数据递交指导原则(试行)》中提到“鼓励申办方参照临床数据交换标准协会(Clinical Data Interchange Standards Consortium,CDISC)标准递交临床试验数据及相关的申报资料”。从合规性和数据处理高效的双重角度出发,依据CDISC数据标准来处理肿瘤相关数据无疑是明智之举。下面,我们将从SDTM(Study Data Tabulation Model,研究数据列表模型)和ADaM(Analysis Data Model,分析数据模型)两个核心标准出发,简要阐述这一数据处理流程。
1.1 肿瘤试验原始数据SDTM标准格式
肿瘤/病灶标识(TU):单一的肿瘤 ID;肿瘤的解剖学位置;标识肿瘤的方法;独立标识肿瘤的角色;以及时间信息。
肿瘤/病灶测量(TR):单一的肿瘤 ID;测试和结果;肿瘤评估者的角色;以及时间信息。
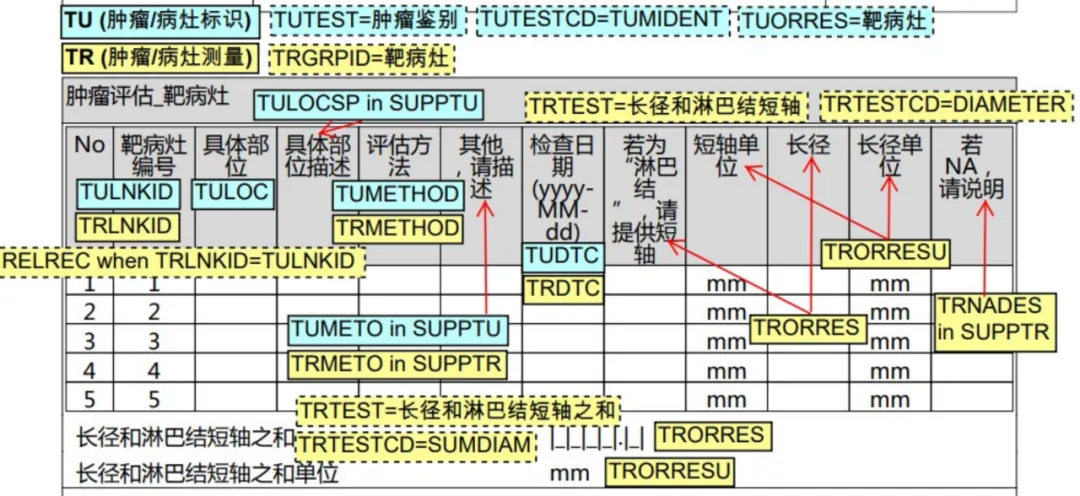
图1:靶病灶页

图2:非靶病灶页

图3:新病灶页
疾病效应/状态评估(RS):TR数据决定的反应评估。

图4:肿瘤总体评估页
1.2 肿瘤试验常见分析数据集ADaM标准格式
02. 疗效指标定义及衍生过程
最佳疗效评估(BOR)
考虑各种需要确认的要求后,从研究治疗开始至试验结束的最佳疗效记录。患者的最佳疗效评估主要依赖靶病灶和非靶病灶的结果以及新病灶的出现情况。此外,还依赖于试验性质、方案要求及结果衡量标准。具体来说,在以肿瘤缓解为主要终点的非随机试验中,部分缓解(PR)或完全缓解(CR)的疗效确认是必须的,以确认哪个是最佳整体疗效评估。
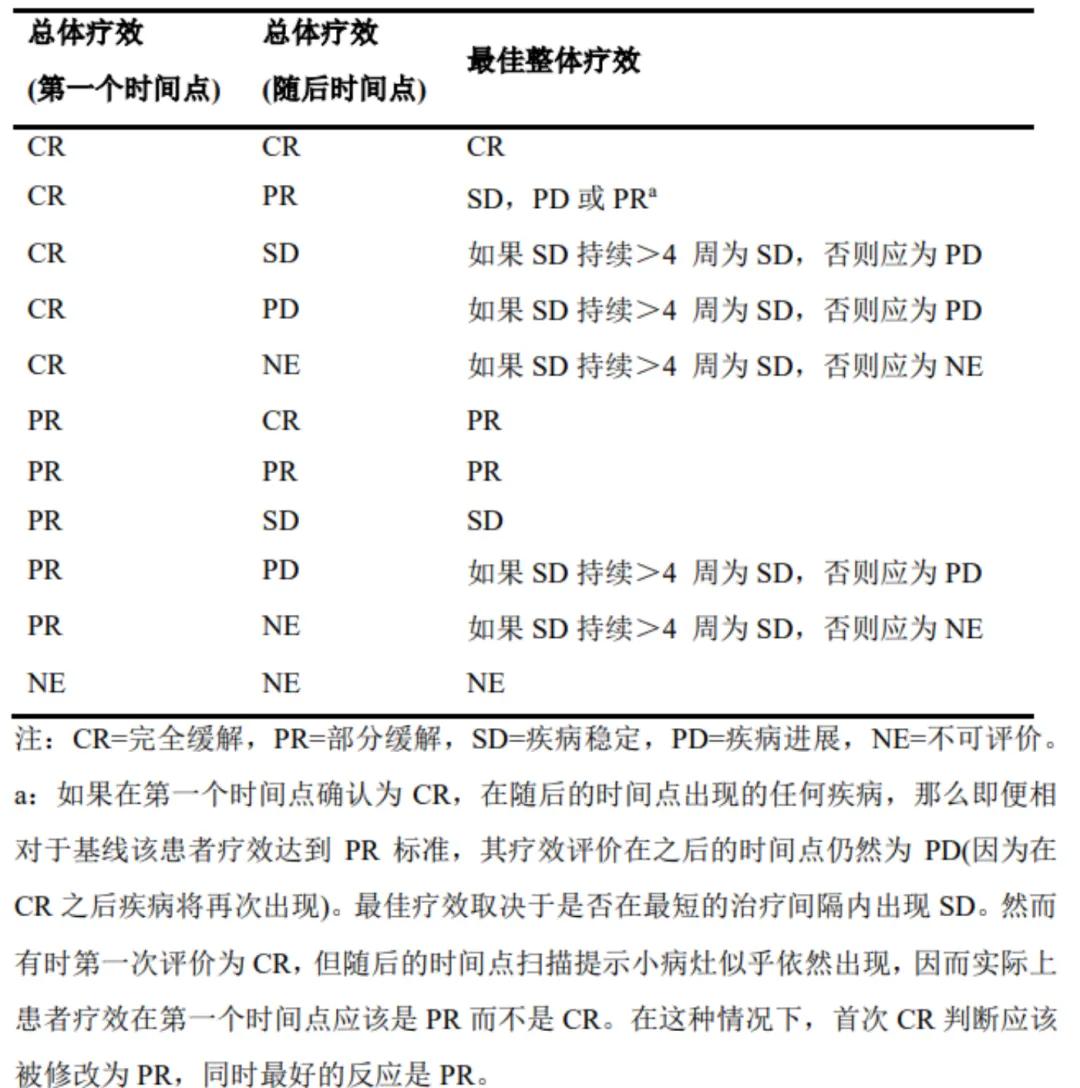
图 5:BOR判断规则
客观缓解率 (Objective response rate, ORR)
是指肿瘤体积缩小达到预先规定值并能维持最低时限要求的患者比例(主要针对实体肿瘤而言),根据肿瘤缩小程度分为完全缓解(CR)和部分缓解(PR)。
疾病控制率 (Disease control rate, DCR)
指按照公认的缓解评价标准(如实体瘤 RECIST 1.1 版),肿瘤经治疗后获得缓解(CR+PR)和疾病稳定(SD)并能维持最低时限要求的患者比例。
对于时间-事件指标
涉及生存时间、完全数据以及删失数据。

图6:常见时间-事件疗效指标的删失规则
总生存期 (Overall survival, OS)
指从首次给药至因任何原因引起死亡的时间。
无进展生存期 (Progression freesurvival , PFS)
从首次给药至首次出现疾病进展或死亡的时间。
缓解持续时间(DoR)
定义为肿瘤第一次评估为 CR 或 PR 开始到第一次评估为 PD或任何原因导致死亡的时间。
肿瘤进展时间(TTP)
从首次给药至明确的疾病进展之日所经历的时间。不包括死亡。
03. 统计分析方法常见描述
肿瘤总体评估
PFS、DoR、TTP和OS
靶病灶直径总和
04. 统计分析常见图表模板

图7:肿瘤最佳总体疗效评价总结模板

图8:缓解持续时间总结模板

图9:缓解持续时间生存曲线图模板

图10:游泳图模板

图11:瀑布图模板

图12:蜘蛛图模板
05. SAS程序实现代码
1)临床试验中常使用二项分布精确概率法(Exact (Clopper-Pearson) Confidence Limits)计算率的置信区间。

2)对时间-事件类型指标使用Kaplan-Meier法,该方法由Kaplan和Meier于1958年提出,又名乘积极限法。乘积的含义:生存率=生存概率的乘积;极限的含义:标准寿命表法中的时间区间长度趋近于0。

3)生存曲线图程序实例

注:有时出现中位PFS置信区间不存在,是因为事件数太少,删失数大于事件数。这时从生存曲线图中会看到不同分析队列生存时间对应的概率都大于0.5,中位生存时间不存在,同时也无法计算置信区间。
4)对于瀑布图、游泳图和蜘蛛图每个公司都有自己的template或宏程序,这里不再放置。
参考文献:
[1] 国家药品监督管理局,《药物临床试验数据递交指导原则(试行)》 ,2020年7月
[2] https://www.cdisc.org/standards/foundational/sdtmig,SDTMIG v3.3, 20 November 2018
[3] 国家药品监督管理局, 《抗肿瘤药物临床试验技术指导原则》 2012年5月
[4] 国家药品监督管理局,《抗肿瘤药物临床试验终点技术指导原则》, 2012年5月
[5] 国家药品监督管理局, 《抗肿瘤药物临床试验统计学设计指导原则(试行)》, 2020年12月
有临来雅
上海有临医药子公司,成立于 2019 年,致力于给国内外创新药、疫苗与医疗器械企业。提供临床试验统计咨询、试验设计、数据管理统计分析与编程等多方面专业服务。团队由数十位来自国内外知名药企和临床 CRO,拥有平均十年左右行业经验的核心技术人员及专家构成。洞悉行业政策及标准,以客户需求为导向,不断优化迭代形成最佳实践和服务模式。适应不同业务需求,开创灵活创新的合作模式: 包括数统全方位大包服务、业务流程外包(FSP)、战略合作、专家咨询与培训、监督管理及人员外派。为客户降本增效,加速新药研发与上市进程。
生物统计服务
有临来雅生物统计团队致力于为客户提供全方位生物统计专业服务,包括临床开发策略咨询、试验设计和临床方案撰写、试验启动相关统计准备工作(随机化方案、编盲、SAP等)、项目实施统计服务(统计分析、解读和报告)以及协助与监管机构的统计沟通。团队基于生物统计科学、依据监管机构(NMPA和USFDA等)法律法规以及生物统计相关指导原则,结合在药企和CRO多年经验积累,为医药企业提供高品质和专业的生物统计解决方案,加速新药研发进度和产品上市。有临来雅统计分析与编程团队致力于为客户提供卓越的一站式符合CDISC标准的统计编程服务,更好地支持临床试验注册和上市申请。
撰写:王素丽
审核:章飞燕、张子豹