2025-06-30
有临医药

随着社会经济快速发展和生活方式、饮食结构的变化,我国高尿酸血症(HUA)患病率逐年增高,最新研究结果显示,我国成人居民HUA患病率为14.0%,男性与女性患病率分别为24.5%和3.6%[1]。高尿酸血症已成为了继糖尿病后的第二大代谢性疾病,且呈现明显的年轻化趋势,然而,其公众知晓率和治疗率均处于较低水平,是易被忽视的公共卫生问题。除痛风外,高尿酸血症还被证实与肾损伤、心血管损伤、代谢综合征等多种疾病的发生发展密切相关。
HUA的定义为非同日、2次空腹血尿酸>420 μmol/L(成年人,不分男性、女性)[2]。且受年龄、性别、种族、遗传、饮食习惯、药物等多种因素影响。总体而言,其患病率随年龄增长而增高,男性高于女性。依据血尿酸(SUA)水平和尿尿酸排泄情况,HUA还分为尿酸排泄不良型、尿酸生成过多型、混合型三种类型,约90%的原发性HUA属于尿酸排泄不良型[3]。
尿酸由饮食摄入和体内分解的嘌呤化合物在肝脏中产生,约2/3尿酸通过肾脏排泄,其余由消化道排泄。尿酸经肾小球滤过、近端肾小管重吸收、分泌和分泌后再吸收,未吸收部分从尿液中排出。正常情况下,体内尿酸产生和排泄保持平衡,如果肝脏代谢和细胞更新产生过多尿酸,或肾脏/肾外尿酸排泄不足,则会导致HUA的发生,其中尿酸排泄不足是主要原因。肾脏排泄过程由一系列顶端和基底侧表达的分泌和重吸收分子控制,分为重吸收尿酸-阴离子交换器(URAT1/SLC22A12, OAT4/SLC22A11, OAT10/SLC22A3)、重吸收GLUT9/SLC2A9尿酸盐转运体、分泌阴离子交换转运体(OAT1, OAT2, OAT3)、磷酸钠转运蛋白等[4]。

尿酸产生及排泄过程
尿酸生成过多或排泄不足会导致高尿酸血症的形成,这种状态会促进尿酸钠晶体(MSU)的产生,当尿酸盐结晶沉积在关节处时,会引发剧烈的炎症反应,导致痛风发作,而反复发作的痛风会造成关节的破坏、畸形,甚至残疾。
除了对关节的破坏,高尿酸还是潜藏的肾脏杀手。尿酸盐结晶沉积在肾脏,会引发尿酸性肾结石,长期高尿酸状态还会损害肾小管和肾间质,最终引发慢性尿酸性肾病,致使肾功能下降,甚至肾衰竭,肾功能不全又是痛风的重要危险因素。大量研究证实,随着SUA水平增高,慢性肾病(CKD)、糖尿病肾病的患病率显著增加,而生存率显著下降,而且,血尿酸也是急慢性肾功能衰竭发生及预后差的强有力的预测因素[5]。
SUA可预测心血管及全因死亡,是预测心血管事件发生的独立危险因素。SUA每增加60 μmol/L,与正常SUA 相比,冠心病死亡的风险增加12%。女性患者的相关性更为显著[6]。HUA更是心力衰竭、缺血性卒中发生及死亡的独立危险因素。降低SUA可以显著改善冠脉血流及扩张型心肌病的左室功能,减少高血压肾病患者心血管及全因死亡的风险。
HUA还常常与肥胖、高血脂、胰岛素抵抗/糖尿病并存,这些因素相互促进,形成恶性循环,进一步加重身体的代谢紊乱。HUA是二型糖尿病(T2DM)发生发展的独立危险因素,T2DM发病风险随着SUA水平的升高而增加,普通人群中SUA水平每增加60 μmol/L,新发糖尿病的风险增加17%[7]。
HUA还可能会增加神经退行性疾病(如阿尔茨海默病)的风险,虽然目前相关研究还在进行之中,但这为我们敲响了警钟,指引着科学探索的方向。
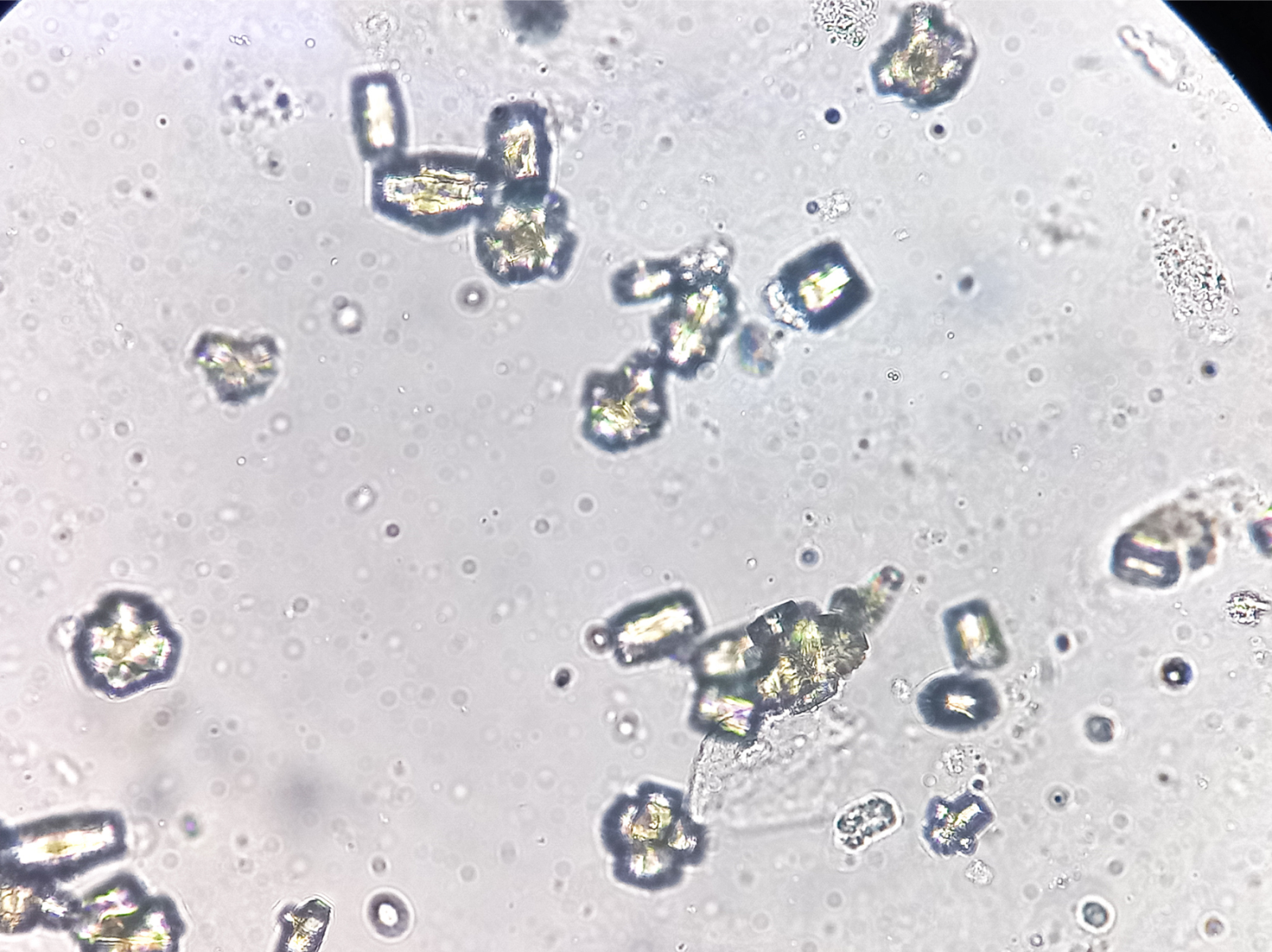
显微镜下的尿酸晶体
对于HUA的治疗,一般患者SUA水平建议降至<6mg/dl(360 μmol/L),严重的痛风患者或有痛风石的患者建议降至<5mg/dl(300 μmol/L),以达到溶解尿酸结晶的目的。然而HUA患者治疗达标率较低,且传统药物存在明显局限性,尿酸生成抑制剂中,别嘌醇单药治疗达标率低且中国人群易出现超敏反应[5]。非布司他可用于别嘌呤醇治疗无效或不耐受的患者,但存在心血管疾病相关死亡发生率增高的风险,并被FDA要求增加黑框警告。尿酸排泄促进剂中,丙磺舒由于药药相互作用相关,以及其过高的给药剂量(1000 mg日剂量)和给药频率(每天2~4次),很少被推荐使用。苯溴马隆有潜在的肝脏毒性,并有引发急性肝炎的风险,由于严重肝损害,已从欧洲市场撤市,在中国仍可应用于临床[8]。这几类一线治疗药物在临床上虽然都被广泛使用,但是它们在治疗上都有一定的缺陷,疗效差、副作用大、花费大是其临床应用的一些主要瓶颈,同时这些一线治疗药物在患者中都具有一定的使用限制。因此,新的有效和方便的治疗方案,对于那些未达到预期治疗目标并且需要进一步降低尿酸水平以控制病情的患者显然是急需的。
尿酸转运蛋白1(urate transporter 1,URAT1)是一种位于人肾近曲小管上皮细胞顶膜的阴离子膜转运蛋白,主要作用是控制肾脏中尿酸的重吸收,而URAT1约占肾脏尿酸重吸收蛋白的90%,且相较于其他转运蛋白对尿酸具有更高的亲和力和运转效率,因此URAT1抑制剂是降尿酸药物研发领域的一大热点。
目前已有4款URAT1抑制剂上市,包括丙磺舒、苯溴马隆、Lesinurad和Dotinurad。其中Lesinurad已在美国撤市。
2024年12月国家药品监督管理局药品审评中心(CDE)批准了卫材中国的Dotinurad上市,也是中国唯一获批上市的URAT1高选择性抑制剂,Dotinurad在苯溴马隆的基础上改造了苯环相邻环结构,从而降低了肝毒性,其降尿酸作用不逊于非布司他和苯溴马隆。Dotinurad可以基于患者尿酸水平和耐受程度以每天0.5~4.0mg一次的剂量给药并可长期维持。Dotinurad服药后不良反应都较为轻微,没有严重的不良反应发生以致停药,也可以在不调整剂量的情况下用于老年患者、肝功能不全或轻度至中度肾功能不全的患者[9]。
此外,国内外处于临床研究阶段或申请上市阶段的URAT1抑制剂共14个,如下表所示:
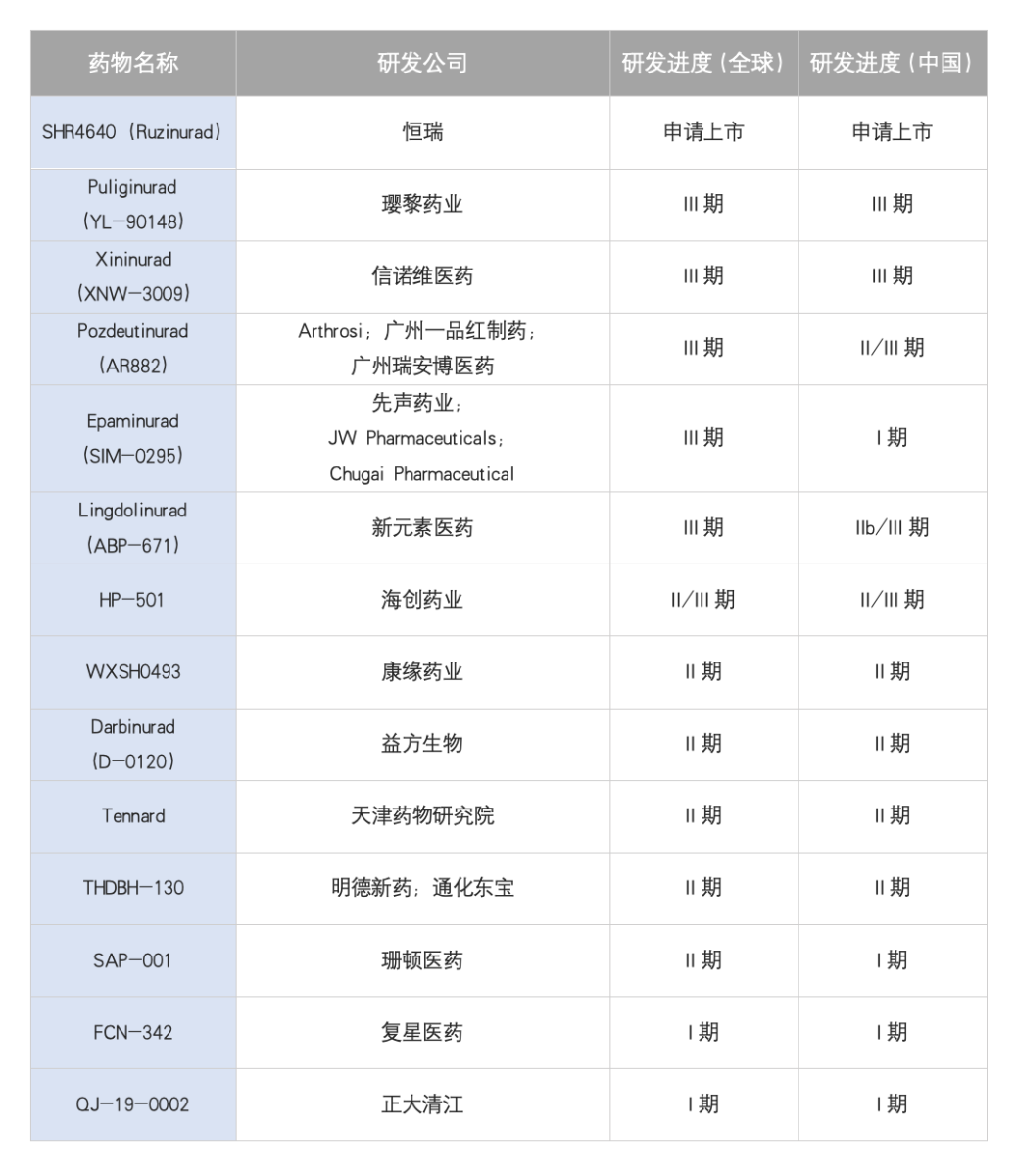
恒瑞医药的SHR-4640是国内研发速度最快的URAT1抑制剂,已于2025年1月9日获得上市申请受理。SHR4640已开展临床研究结果显示,SHR-4640单用或联合非布司他降尿酸效果明显优于安慰剂或对照药物,且安全性、耐受性良好。
一品红的AR882已在美国进入III期临床研究,与现有治疗方案相比,AR882在痛风患者中展现出更显著的疗效与更高的安全性。
璎黎药业的YL-90148在中国与美国同步开展III期临床,I期数据显示其具备良好的药代动力学特性,可显著提升尿酸肾脏清除率,降低血清尿酸水平,且安全性特征优异,为后续开发奠定基础。
HUA作为一种日益普遍的代谢性疾病,其潜在危害不容忽视,不仅与痛风紧密相关,还影响着肾脏、心血管系统及全身代谢健康。面对当前治疗手段的局限性和患者治疗达标率低的现状,URAT1抑制剂的研发与应用为HUA的治疗带来了新的希望。
参考文献
[1] 方宁远,吕力为,吕晓希,等. 中国高尿酸血症相关疾病诊疗多学科专家共识(2023年版) [J]. 中国实用内科杂志, 2023, 43 (06): 461-480.
[2] 中华医学会内分泌学分会. 中国高尿酸血症与痛风诊疗指南(2019)[J]. 中华内分泌代谢杂志,2020,36(01): 1-13.
[3] Dincer HE, Dincer AP, Levinson DJ. Asymptomatic hyperuricemia: to treat or not to treat. Cleve Clinic J Med, 2002, 69: 594-608.
[4] Dalbeth N, Merriman TR, Stamp LK. Gout. Lancet. 2016;388(10055):2039-2052.
[5] 中华医学会内分泌学分会.高尿酸血症和痛风治疗的中国专家共识[J].中华内分泌代谢杂志.2013,29(11):913-920.
[6] Kim SY, Guevara JP, Kim KM, et al. Hyperuricemia and coronary heart disease: a systematic review and meta-analysis. Arthritis Care Res (Hoboken), 2010, 62: 170-180.
[7] Kodama S, Saito K, Yachi Y, et al. Association between serum uric acid and development of type 2 diabetes. Diabetes Care, 2009, 32: 1737-1742.
[8] 杨莉萍. 降低血尿酸水平的药物荟萃[J]. 中国心血管杂志, 2016, 21(2):100-103.
[9] Song D, Zhao X, Wang F, et al.A brief review of urate transporter 1 (URAT1) inhibitors for the treatment of hyperuricemia and gout: Current therapeutic options and potential applications[J].Eur J Pharmacol,2021,907: 174291.
叶小彤 撰写/李晓梅 审核